循环肿瘤DNA(ctDNA)已显示出作为膀胱癌管理的预后生物标志物潜力。目前针对肌层浸润性膀胱癌患者的监测指南建议加强术后监测。本研究旨在评估ctDNA与影像学检查在检测根治性膀胱切除术后疾病复发中的诊断效能。研究者分析了2021-2023年单一机构接受机器人辅助根治性膀胱切除术并前瞻性进行肿瘤知情(tumor-informed)ctDNA分析(Signatera™)的患者。纳入有术后影像学和ctDNA结果的患者,排除非尿路上皮组织学或ctDNA数据缺失者。以影像学结果为参考标准,ctDNA为指标检测,在患者水平评估诊断准确性,计算ctDNA检测的灵敏度、特异性、阳性预测值(PPV)和阴性预测值(NPV)。
共纳入94例患者(中位年龄70岁,IQR 63-77),多数为≥pT2期疾病(75.4%),淋巴结阴性(71.3%)。中位随访16个月(IQR 9-22)期间,共进行388次影像学检查和283次ctDNA检测。ctDNA检测灵敏度和NPV均为100.0%(95% CI 100.0-100.0%),特异性为91.8%(95% CI 87.6-95.5%),PPV为84.5%(95% CI 76.8-91.3%)。
ctDNA检测可能成为膀胱切除术后膀胱癌监测的有价值工具。ctDNA持续未检测到的患者可能因复发风险较低而受益于强度较低的监测方案。这一策略需进一步研究以验证其临床实用性,并支持纳入常规临床实践。
本研究的新发现:
本研究表明,ctDNA检测可有效识别膀胱癌术后复发低风险患者,有望减少频繁影像学检查的需求。与涉及密集检查安排和辐射暴露的标准影像学方案不同,ctDNA提供了一种个性化、风险适应性方法。研究结果提示,ctDNA可助力在膀胱切除术后制定更具针对性和以患者为中心的监测策略。
临床意义:
近年来,越来越多证据支持膀胱癌患者根治性膀胱切除术后围手术期及辅助系统治疗的应用。然而,系统治疗可能伴随改变生活的毒性,且治疗疗程主要基于临床试验方案,而非个性化治疗策略。本研究回顾了94例接受根治性膀胱切除术的膀胱癌患者的ctDNA结果,传递了两条重要信息:其一,92%可检测到ctDNA的患者出现复发,从检测到ctDNA到影像学复发的中位间隔时间为89.5天;其二,在中位16个月的随访中,ctDNA未检测到的患者均未出现复发。基于这些结果,未来可能将ctDNA纳入诊疗路径,选择合适的患者在合适的时间接受系统治疗。
患者总结:
研究者探讨了血液检测是否有助于判断膀胱癌术后复发风险。结果发现,血液中未检测到肿瘤DNA的患者复发可能性更低。这种方法可减少频繁随访扫描的需求,提高患者的舒适度和安全性。
研究背景
肌层浸润性膀胱癌(MIBC)因根治性膀胱切除术后复发和进展风险高而带来显著挑战,复发率可达50%。这凸显了对可靠生物标志物以指导监测和治疗的迫切需求。影像学检查在术后监测中至关重要。当前指南建议,术后前2-3年每3-6个月进行胸部成像及腹部和盆腔断层成像(通常使用CT或MRI),之后每年评估一次。
PET-CT在怀疑转移的病例中应用日益增多,尤其是在传统影像学检查结果不明确时。PET-CT检测复发的灵敏度(87-100%)和特异性(76-100%)较高,在检测尿路上皮癌方面通常优于CT和MRI。然而,反复CT扫描带来的累积辐射暴露问题值得关注,尤其是对可能需要数十年长期监测的年轻患者。此外,PET-CT和MRI的可及性在某些地区仍有限。再者,膀胱癌随访方案的高不依从率令人担忧,因密集监测缺乏1级证据支持。
ctDNA是一种有前景的非侵入性生物标志物,可实时反映肿瘤动态,有助于监测疾病进展、检测复发并实现实体瘤治疗策略的个性化。当前研究正探索ctDNA在不同阶段和类型泌尿外科肿瘤中的作用。例如,ABACUS试验表明,ctDNA阴性强烈预示无疾病复发,而Christensen等人报道ctDNA检测复发的灵敏度达100%,特异性达98%。研究者此前报道,膀胱切除术前可检测到ctDNA与接受根治性膀胱切除术患者的不良病理和生存结局相关。相比之下,膀胱切除术前ctDNA不可检测到且持续不可检测到与更好的肿瘤学结局相关。这些发现具有重要临床意义,尤其对膀胱切除术后的治疗强度选择。尽管早期数据前景广阔,但将ctDNA整合到膀胱切除术后常规监测方案中仍处于发展阶段,需进一步验证。
本研究的目的是评估ctDNA对比影像学检查在检测根治性膀胱切除术(RC)后疾病复发方面的诊断效能。
研究方法
研究者利用 2021 年至 2023 年间接受机器人辅助根治性膀胱切除术(RARC)的连续患者前瞻性维护数据库中的数据,开展了一项单机构诊断准确性研究。纳入标准为组织学证实的尿路上皮癌,且至少有一项术后 ctDNA 结果与断层成像检查(两者检测时间差在 45 天内)可用。排除标准包括非尿路上皮组织学类型(如神经内分泌癌、鳞状细胞癌或腺癌)、RARC 后缺乏影像学和 ctDNA 数据,以及两种检查方式之间存在显著时间错位(>45 天,约6 周)。
术后监测遵循既定的临床指南,包括在前2 年内每 3-6 个月进行胸部、腹部和盆腔 CT 扫描(或根据泌尿科医生的判断进行腹部 MRI 或 PET-CT),并根据患者的病理分期和分级进行调整;早期成像则基于临床判断。在该机构,计划接受RARC 的膀胱癌患者和接受新辅助治疗的患者常规进行 ctDNA 分析。术后,根据标准化方案每 6-12 周采集系列 ctDNA 样本进行持续监测,以最大限度地减少检测频率和时间的变异性。
所有ctDNA 检测均使用 Signatera™检测(Natera, Austin, TX, USA),这是一种基于聚合酶链反应的tumor-informed多重下一代测序平台,可追踪从肿瘤全外显子测序和匹配的胚系DNA中获得的 16 个克隆肿瘤特异性变异。如先前验证的那样,如果至少两个变异超过预定的置信阈值,则样本为 ctDNA 阳性。术前 ctDNA 状态使用TURBT期间获得的标本确定。TURBT 样本用于建立术前状态和患者整个术后监测期间的 ctDNA panel。在研究期间,共对94 名患者进行了 283 次 ctDNA 分析。
RARC 1个月内采集的血清样本用于评估 ctDNA 状态。术后,每 6-12 周采集用于 ctDNA 分析的血液样本,包括在最小残留疾病(MRD)窗口内(术后 90 天)的初始样本。研究者在不同时间点将ctDNA 状态分为可检测到和不可检测到,并评估每个时间点ctDNA 转换的动态,在可用时将结果与同期影像学检查结果进行比较。
在亚组分析中,研究者将患者分为两组:“ctDNA 不可检测到”组,定义为术后首次评估及整个随访期间 ctDNA 持续不可检测到的患者;“ctDNA 可检测到”组,包括在MRD窗口内 ctDNA 可检测到的患者和在监测窗口内状态从不可检测到变为可检测到的患者(n=8)。
真阳性结果定义为ctDNA 可检测到且影像学证实复发。假阳性结果定义为ctDNA 可检测到但影像学未证实复发。真阴性结果定义为ctDNA 不可检测到且无复发。假阴性结果定义为ctDNA 不可检测到但影像学证实复发。时间差定义为首次检测到ctDNA 结果与影像学证实复发之间的间隔,考虑到早期复发(术后 < 90 天)可能反映残留疾病,计算时包括和排除早期复发。
研究结果
队列基线特征:
在94例患者中,55例(59%)ctDNA不可检测到,39例(41%)ctDNA可检测到,中位随访时间为16个月(IQR 9-22)。患者中位年龄为70岁(IQR 63-77),80.9%为男性。26%的≥cT2期患者接受了新辅助治疗:2例患者接受免疫检查点抑制剂治疗,11例仅接受顺铂化疗,4例两者均接受。ctDNA可检测到与更晚期的病理分期(T3-T4期:59% vs 25.5%)和更高的淋巴结受累率(N2期:33.3% vs 9.1%)相关。随访期间共有36例患者经影像学证实复发,所有复发患者ctDNA均为可检测到状态。两组间辅助治疗率无显著差异(38.5% vs 21.8%;表1)。
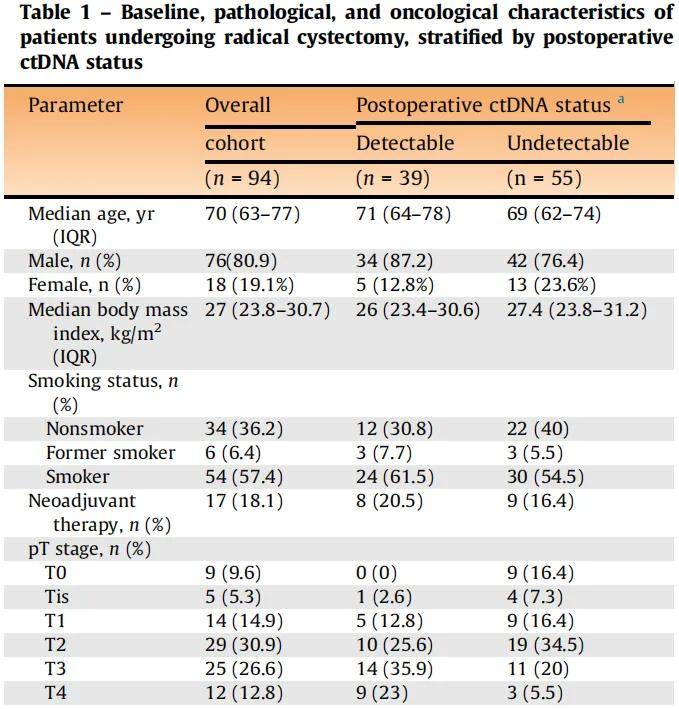
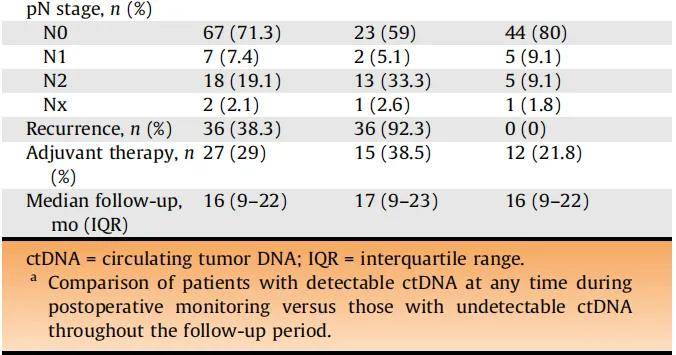
表1
影像学检查与ctDNA分析:
在388项影像学检查中,121项结果为阳性,267项为阴性。同期ctDNA检测显示,111份样本可检测到ctDNA,172份不可检测到。ctDNA与影像学检查的一致性为82.6%。15例(15.5%)出现不一致结果,包括11例ctDNA阳性但影像学阴性的患者,其中8例后来出现复发,3例失访(图1)。ctDNA的敏感性和阴性预测值(NPV)均为100.0%(95% CI 100.0-100.0%),特异性为91.8%(95% CI 87.6-95.5%),阳性预测值(PPV)为84.5%(95% CI 76.8-91.3%),准确性为94.3%(95% CI 91.7-97.0%)。F1分数为91.5%(95% CI 86.9-95.5%),Youden指数为91.8%(95% CI 87.6-95.5%)。从检测到ctDNA到影像学证实复发的中位时间差总体为89.5天(IQR 34-121),排除早期复发或3个月内ctDNA阳性后为65天(IQR 20-110)(图2)。ctDNA检测与影像学检查的中位间隔时间为1天(IQR -22至18),表明时间匹配紧密(图3)。
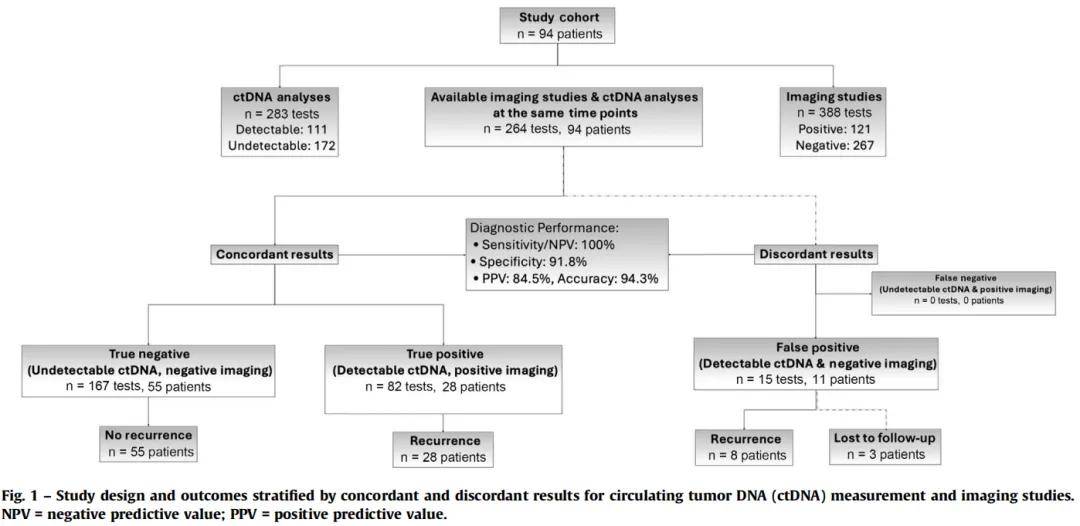
图1
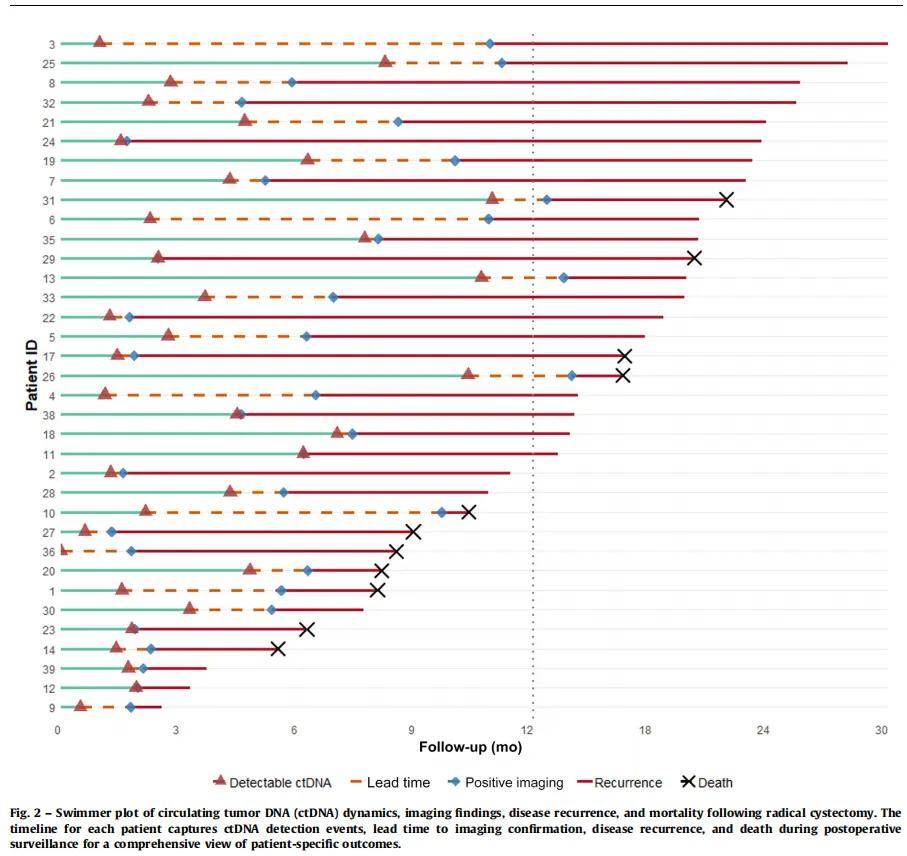
图2
图3
RARC后3个月内ctDNA可检测到的所有患者均出现复发,而同期ctDNA不可检测到的患者中无复发病例。这一模式在整个随访期间持续存在。Kaplan-Meier分析显示,ctDNA不可检测到组的无复发生存期(RFS)显著更长(对数秩检验p < 0.0001)。ctDNA不可检测到组的RFS率在24个月时仍为100%,而ctDNA可检测到组在6个月时降至58.5%,12个月时21.3%,18个月时13.3%,24个月时8%。
讨 论
本研究强调了ctDNA作为监测MIBC患者复发的可靠生物标志物的潜力。对于膀胱切除术后ctDNA持续不可检测到的患者,中位随访16个月时NPV为100%,表明该组患者的复发风险极低。ctDNA灵敏度为100%,特异性为91.8%,诊断性能强劲,在复发早期检测方面优于影像学检查。排除早期复发后,ctDNA检测到影像学确认复发的中位时间差为65天,突显了ctDNA在放射学证实前检测复发的潜力。
Tumor-informed ctDNA检测可增强对MRD的检测,有助于更早识别复发并监测治疗效果。这些发现与ABACUS试验一致,该试验中新辅助治疗后ctDNA阴性患者未出现复发。此外,ctDNA分析在检测转移性复发方面已显示出高灵敏度和特异性。这强调了ctDNA检测在早期风险分层和纵向监测中的价值。
当前膀胱癌监测指南严重依赖膀胱切除术后每3-6个月的断层成像检查。尽管有这些密集的监测方案,但与前列腺癌的前列腺特异性抗原和结直肠癌的癌胚抗原不同,膀胱癌(尤其是MIBC)在分子水平上缺乏广泛接受的用于检测复发或残留癌的生物标志物。这一空白凸显了对创新方法(如使用新型生物标志物)的需求。
先前在其他癌症(如结直肠癌和肝细胞癌)中的研究表明,ctDNA的NPV高达82%-100%。一项涉及I-III期乳腺癌、胰腺癌、结直肠癌和黑色素瘤的研究显示,48例ctDNA不可检测到的患者均未复发,与本研究的发现一致。尽管在其他癌症中ctDNA检测复发的提前时间(如乳腺癌(10.7个月)和结直肠癌(8.7个月))长于膀胱癌,但这种差异可能反映了肿瘤生物学和进展动力学的差异。ctDNA已成为膀胱癌复发早期检测的有前景的生物标志物。Christensen等人报告,ctDNA检测与放射学确认之间的中位时间差为96天(约3个月),这与其他研究ctDNA动态与复发相关性的研究一致,这些研究一致表明ctDNA在临床或影像学证据出现前识别分子复发的灵敏度更高。未检测到ctDNA的患者无复发病例,这可能是由于个体化tumor-informedctDNA检测的高灵敏度以及随访时间较短(可能漏诊晚期复发)。MIBC的复发模式(通常为腹腔内或转移性)有助于血液中ctDNA的快速检测。
ctDNA作为一种非侵入性实验室检测,无需面诊即可进行监测,具有降低患者费用和出行负担的潜力。更少的放射扫描将减少辐射暴露以及预约和保险审批等后勤障碍,可能减轻患者负担,这使得ctDNA监测成为更易获得的替代方案。将ctDNA分析纳入标准影像学方案可通过制定个性化监测策略改善临床结局。对于ctDNA不可检测到的低风险患者,减少影像学检查频率可能足够,从而在保持有效监测的同时降低辐射暴露和影像学成本。相反,ctDNA检测早期复发的能力可促进对高风险患者的及时干预,并可能改善长期结局。此外,研究表明,将ctDNA检测纳入监测方案是一种具有成本效益的策略,分析表明,即使ctDNA检测成本翻倍,其成本仍低于密集影像学检查。需要进一步的成本效益研究来评估基于ctDNA的监测是否可以通过减少不必要的影像学检查和早期检测复发来降低整体医疗成本,并有可能通过早期干预实现成本节约。
在本队列中,辅助治疗决策由标准病理因素而非ctDNA状态指导。因此,本研究数据无法就ctDNA驱动的辅助治疗作用得出明确结论。然而,IMvigor010试验的证据表明,与观察相比,接受辅助阿替利珠单抗治疗的ctDNA阳性患者的无病生存期和总生存期显著更好(风险比0.58;p=0.002)。正在进行的试验如TOMBOLA(NCT04138628)、IMvigor011(NCT04660344)和MODERN(NCT05987241)正在积极探索ctDNA指导的治疗策略。TOMBOLA专注于膀胱切除术后基于ctDNA的监测,并为ctDNA阳性患者启动阿替利珠单抗治疗,而IMvigor011则在类似的高风险ctDNA阳性人群中评估辅助阿替利珠单抗与安慰剂的疗效。
本研究存在若干局限性。回顾性设计和小样本量(94例患者)限制了研究结果的普遍性。中位随访16个月可能未捕捉到晚期复发,因为MIBC复发可能发生在该时间段之后。此外,本队列未纳入组织学类型为异质性或神经内分泌癌的患者。因此,该队列中ctDNA的诊断性能应在未来研究中进一步评估。此外,无假阴性结果可能反映了肿瘤个体化ctDNA检测方法的高特异性,该方法追踪经过验证的肿瘤特异性突变,降低了ctDNA阴性患者中疾病未被检测到的可能性。此外,成像方式的异质性和外部影像评估可能影响了复发检测和时间差估计,因为不同技术在检测复发性疾病的敏感性上存在差异。
本研究的所有分析均使用Signatera™检测;其他检测方法的灵敏度和特异性可能不同。此外,由于患者不依从或后勤障碍导致的ctDNA或影像学检查缺失、手术技术的可变性、新辅助和辅助治疗以及患者合并症可能影响ctDNA动态。最后,术后ctDNA分析缺乏标准化方案会引入可变性,可能影响ctDNA趋势的解读。
未来研究应优先制定ctDNA分析的标准化方案,包括监测的最佳时间、频率和持续时间。考虑到美国以外地区ctDNA检测的可及性有限,大型多中心前瞻性研究对于在不同人群和临床环境中验证这些发现至关重要。此外,应在经济分析中评估ctDNA指导的MIBC监测的成本效益,并应评估患者报告的结局(如生活质量和心理影响),以充分了解减少影像学检查频率的益处。我们也期待MODERN和IMvigor011等正在进行的试验结果,这些试验可能进一步深入了解ctDNA监测在优化围手术期管理中的效用。
本研究结果表明,ctDNA检测可作为膀胱切除术后监测的工具,具有高特异性,且ctDNA持续不可检测到的患者无复发。这些患者可能受益于强度较低的监测方案,其中个性化监测与其较低的复发风险一致。可检测到ctDNA显示出作为复发早期生物标志物的潜力,有必要进行进一步研究以验证其临床效用并支持将其纳入常规实践。
参考文献:
Eraky A, Ben-David R, Hug B, et al. Bladder Cancer with Undetectable Circulating Tumor DNA After Radical Cystectomy May Be Amenable to a Less Intense Imaging Surveillance Protocol: A Diagnostic Accuracy Study. Eur Urol Oncol. Published online May 19, 2025. doi:10.1016/j.euo.2025.04.027





