胆囊癌肉瘤(CSGB)是一种极其罕见的原发性胆囊恶性肿瘤亚型,由于其非特异性的临床症状和影像学表现,术前误诊率较高,且术后短期内复发率高,导致预后极差。通过检索医学文献,研究人员发现关于CSGB接受综合治疗并取得相对较好疗效的报道较少。本文报道 1 例罕见的携带KRAS G12V突变的CSGB病例,该病例在接受包括手术、化疗、放疗和免疫治疗在内的联合治疗后生存时间达到 32 个月,并针对该疾病进行了文献复习,旨在提高对该疾病的认识。
背 景
胆囊癌肉瘤(CSGB)最早由Landsteiner于 1907 年提出,是原发性胆囊恶性肿瘤的罕见亚型,占胆囊肿瘤的比例不足 1%,具有高度侵袭性且预后不良。Zhang等人关于CSGB的研究显示,该疾病发病中位年龄为 68 岁,男女比例约为 1:3.25,平均生存时间仅 17.5 个月,中位生存期为 5 个月,1 年和 5 年生存率分别为 19±5% 和 16±5%;肿瘤 <5cm 及日本籍患者生存时间更长,胆囊结石存在情况、上皮与间充质成分类型及患者年龄、性别并非重要预后因素。癌肉瘤的发病机制仍不明确,但已提出多种理论,包括间充质反应、碰撞瘤假说、上皮源性恶性增殖、起源于胚胎静止细胞及全能干细胞假说。CSGB发生的危险因素可能与胆囊结石、慢性胆囊炎及胰胆管合流异常(PBM)相关。胆囊癌肉瘤存在较高的漏诊和误诊率,且术后复发率极高,总体预后较差。本文报道 1 例罕见的携带KRAS G12V突变的胆囊癌肉瘤病例(该病例接受综合治疗后获得相对较长生存期),并针对该疾病进行文献复习。本病例报告符合CARE指南。
病 例
患者女,51 岁,因上腹部疼痛就诊于当地医院。患者已出现上腹痛超过 1 个月,无放射痛、恶心或呕吐。腹部未触及肿块,患者无腹部压痛或反跳痛。患者在外院接受了计算机断层扫描(CT)和磁共振成像(MRI)检查,结果显示可能为胆囊癌,病变侵犯胆管,可能存在肝转移。患者在接受腹痛症状治疗后,前往云南省肿瘤医院进一步明确疾病诊断并获得治疗。患者既往无高血压、糖尿病或胆囊炎病史,无肿瘤疾病家族史。患者自述心理状况良好。CT与MRI结果(图1)均显示胆囊壁增厚伴可见肿块,考虑可能为胆囊癌。正电子发射断层扫描/计算机断层扫描(PET/CT)(图2)提示胆囊壁增厚形成约 3.8×2.2 cm大小的软组织肿块,FDG代谢增高,倾向恶性,可能为胆囊癌。病变累及胆囊管及胆总管上段,肝内、肝外胆管轻度扩张。
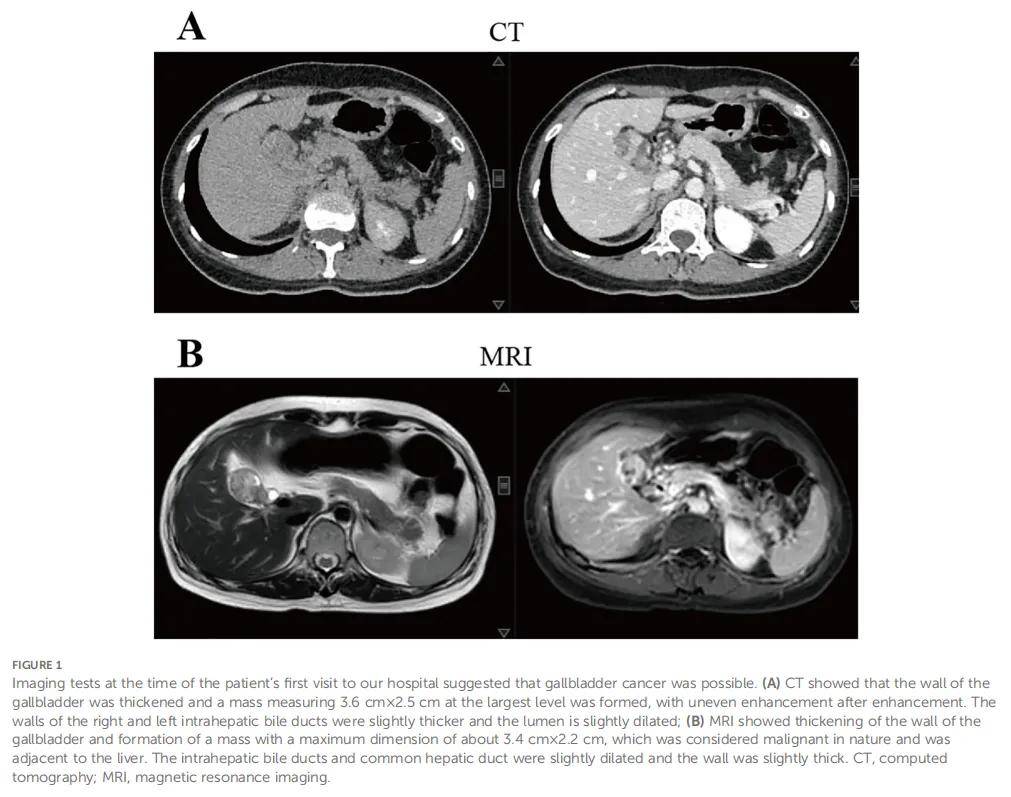
▲图1 患者首次就诊时影像学检查提示胆囊癌可能
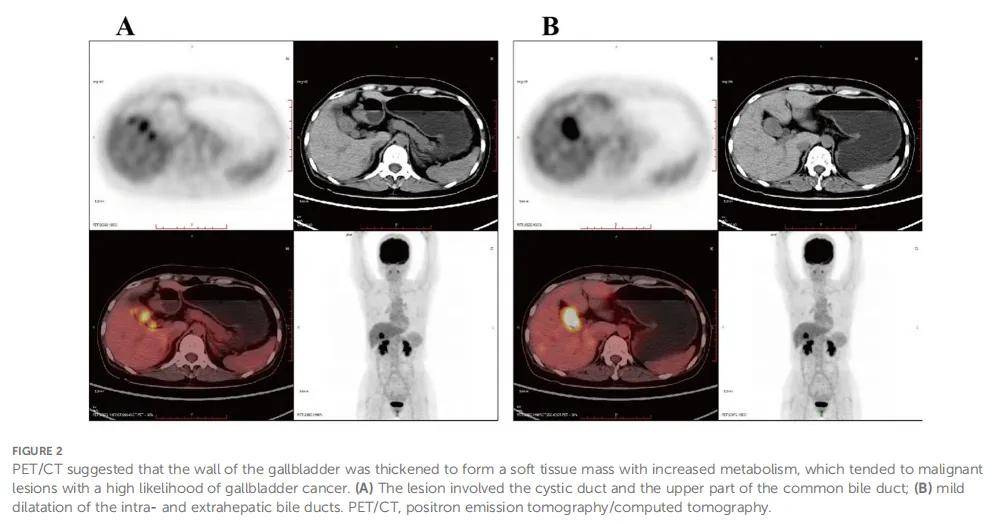
▲图2 PET/CT提示胆囊壁增厚,形成软组织肿块,代谢增高,提示恶性病变,胆囊癌可能性高
经肝胆胰肿瘤多学科诊疗(MDT)讨论后,患者在全身麻醉下行“胆囊癌扩大根治术+肝门部病变切除术+左右肝管成形术+Roux-en-Y肝空肠吻合术”。术后胆囊切除标本大小约 9×5×4 cm,呈灰红色,质地略软。HE染色提示胆囊恶性肿瘤。免疫组化检测以下指标:细胞角蛋白(CK)阳性(+)、波形蛋白(Vim)阳性(+)、CK7阳性(+)、CK20阳性(+)、绒毛蛋白(Villin)阳性(+)、突触素(Syn)阴性(-)、嗜铬粒蛋白A(CgA)阴性(-)、CD56阴性(-)、CK19阳性(+)、CD10阳性(+)、甲胎蛋白(AFP)阴性(-)、Hepar1阴性(-)、ki67阳性(+,40%)、平滑肌肌动蛋白(SMA)阴性(-)、结蛋白(desmin)阴性(-)、CD34阴性(-)、HMB45阴性(-)、S100阴性(-)、胶质纤维酸性蛋白(GFAP)阴性(-)、钙结合蛋白(Calponin)阴性(-)、肌生成素(Myogenin)阴性(-)、MyoD1阴性(-)、CDX2阴性(-)。结合HE及免疫组化结果,患者被诊断为癌肉瘤,分期为IIIA期,镜下可见恶性肿瘤组织血管腔内栓子及神经侵犯。具有代表性的HE及免疫组化图片见图3。
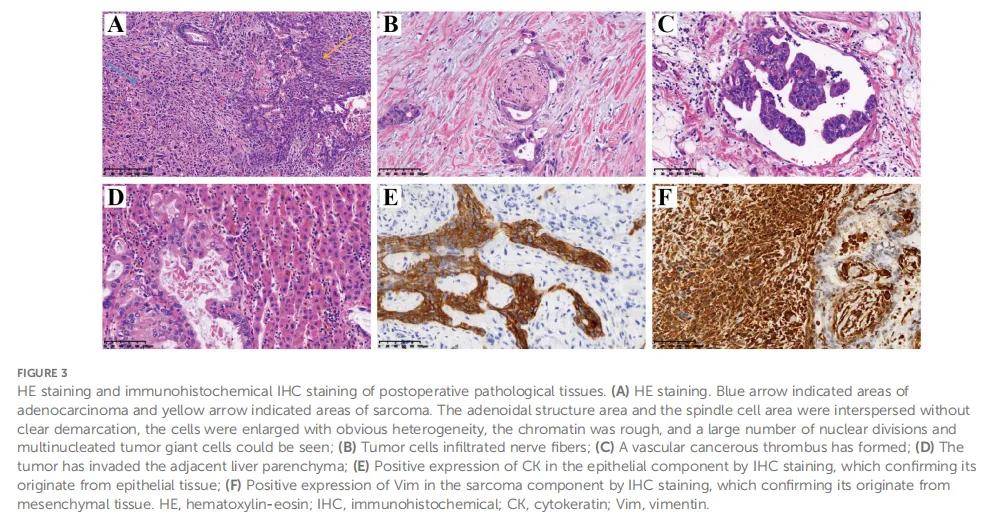
▲图3 术后病理组织HE染色及免疫组化IHC染色
术后,患者接受了 6 个周期“紫杉醇+异环磷酰胺”化疗,并针对术后瘤床及淋巴结引流区进行了放疗(计划靶体积 46.8 Gy/26 次)。患者出现IV度骨髓抑制伴发热、小肠梗阻及肝功能异常等症状,经对症治疗后好转,规律随访后病情稳定。
术后 14 个月检测肿瘤标志物,发现糖链抗原19-9(CA19-9)检测值为 215.40 KU/L,显著高于既往值。正电子发射断层扫描/磁共振成像(PET/MRI)提示胆管术后改变,术区边缘淋巴结FDG增高考虑肿瘤复发及肝内转移,肝门及胃网膜区多发淋巴结肿大考虑转移(图4)。经专家会诊讨论,患者诊断为胆囊癌肉瘤术后复发转移,评估为疾病进展。基因检测提示存在KRAS G12V、APC C4918T、TSC1 C1960G、TP53 C742T、BRCA1突变,无可用靶向药物。予GP方案(吉西他滨 1.2g d1,8;顺铂 28 mg d1-3,q21d)化疗 6 个周期,联合度伐利尤单抗免疫治疗。期间患者反复高热伴寒战、胆红素值升高,考虑胆道感染,经皮肝穿刺胆道引流术(PTCD)(图5)及抗感染治疗后略有改善。因IV度骨髓抑制调整化疗方案为XELOX方案,同期间断口服安罗替尼靶向治疗。期间规律复查CT及MRI,根据RECIST v1.1评估肿瘤病灶为疾病稳定(SD)。遗憾的是,患者因恶性上消化道出血、严重胆道梗阻及感染,于发病 32 个月后去世。
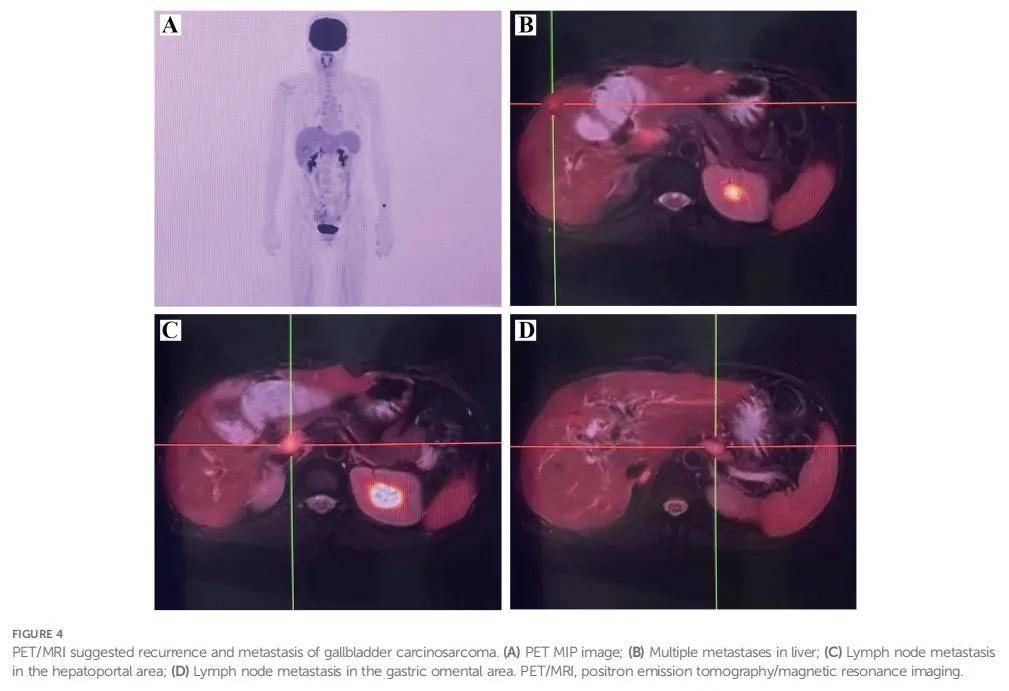
▲图4 PET/MRI提示胆囊癌肉瘤复发转移
▲图5 经皮肝穿刺胆管引流术(PTCD)的超声成像,旨在改善黄疸和胆道感染
与大多数恶性肿瘤患者一样,患者最初难以接受自己患有这种罕见疾病。在接受事实后,患者同意接受手术并积极配合医生进行术后治疗。但不可否认的是,患者焦虑情绪显著增加。因此,医生增加了与患者的沟通,叮嘱患者通过宣泄情绪来缓解心理压力,并建议家属多陪伴她。然而,术后复发给患者带来了巨大打击。骨髓抑制和胆道梗阻也导致患者生活质量下降。在整个疾病诊疗过程中,患者及家属均了解治疗方案并配合医护人员。本病例报道的主要事件时间线见图6。疾病过程中糖链抗原19-9的变化趋势见图7。
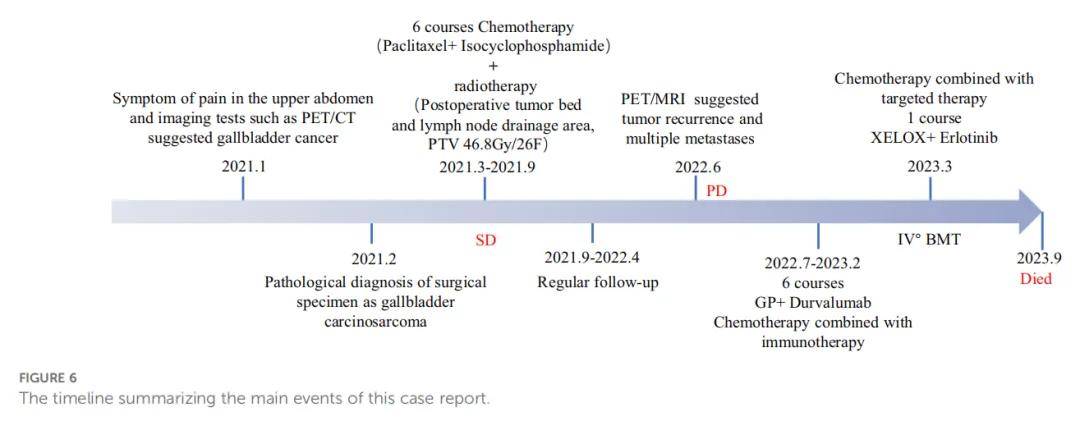
▲图6 患者主要治疗事件时间线
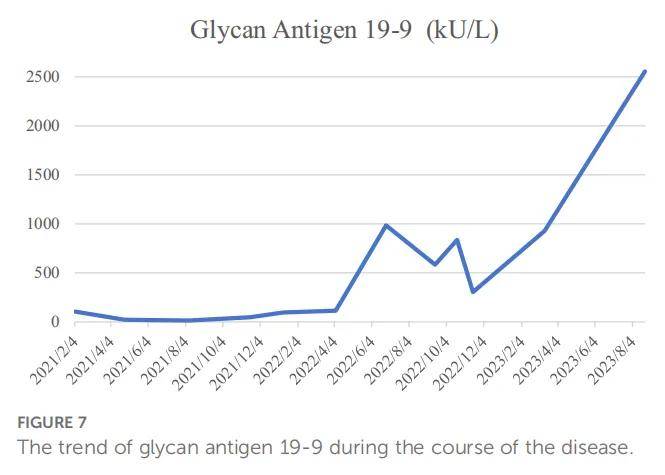
▲图7 疾病过程中糖链抗原19-9变化趋势
讨 论
胆囊癌肉瘤(CSGB)的早期症状不显著,Thomas等人分析了 78 例CSGB病例,其中腹痛占 76.3%,体重减轻、厌食或乏力等非特异性症状占 28.9%,恶心呕吐占 25.0%,13 例(17.1%)出现发热,2 例(2.6%)诊断时无症状。与大多数患者类似,本报道患者的初始症状为上腹痛。CSGB的实验室血清学检查无特异性,较常见肝功能异常。CA199、AFP、CEA等肿瘤标志物可能升高或正常,可辅助CSGB诊断,但特异性较差。CT和MRI在检测恶性肿瘤肝内播散、局部淋巴结受累及远处转移方面比超声更敏感,但CT无法较好区分胆囊癌肉瘤与胆囊腺癌。当CT影像显示肿瘤体积大、瘤内钙化且胆囊形态未改变时,应怀疑CSGB。Joao Cruz等报道CSGB在T1加权像呈等低信号,T2加权像呈不均匀中高信号,可能是区分CSGB与其他胆囊恶性肿瘤的特异性特征。而PET-CT有助于鉴别胆囊良恶性病变,恶性病变的标准化摄取值更高。由于CSGB缺乏特异性影像学表现及血清学标志物,早期准确检出尤为困难。
鉴于CSGB缺乏特异性临床表现及检查结果,术前误诊率高,需依赖手术或取材组织病理学确诊,其特征为同时包含癌性和肉瘤性成分,并可能表现为细胞角蛋白和波形蛋白阳性。胆囊癌肉瘤的癌性上皮成分多为腺癌,也可见鳞状细胞癌;间叶成分范围从同源肉瘤到恶性骨、软骨等其他间叶组织等更异位的成分。Mochizuki等人报道 1 例由腺癌、神经内分泌癌、未分化癌等特定病理成分组成的胆囊癌肉瘤。部分患者中SMA、EMA、P53及结蛋白也可呈阳性。应根据CSGB肿瘤浸润深度及范围选择合适术式。总体而言,若肿瘤局限于黏膜下层,单纯胆囊切除术为更佳选择;若局限于胆囊,可行胆囊切除联合胆囊周围肝组织切除;进展期胆囊癌肉瘤的完整切除仍较困难。然而,即使接受手术治疗,CSGB患者预后仍不理想,局部复发及肝、淋巴结、腹膜转移风险更高。Okabayashi等人开展的研究发现,手术治疗的胆囊癌肉瘤患者 5 年总生存率为 31.0%,院内死亡率为 8.3%,预后较胆囊腺癌更差。研究人员分析了 2000-2024 年文献记载的 19 例接受手术治疗的胆囊癌肉瘤患者数据(表1),其中男性 3 例,女性 16 例,年龄范围 40-88 岁。
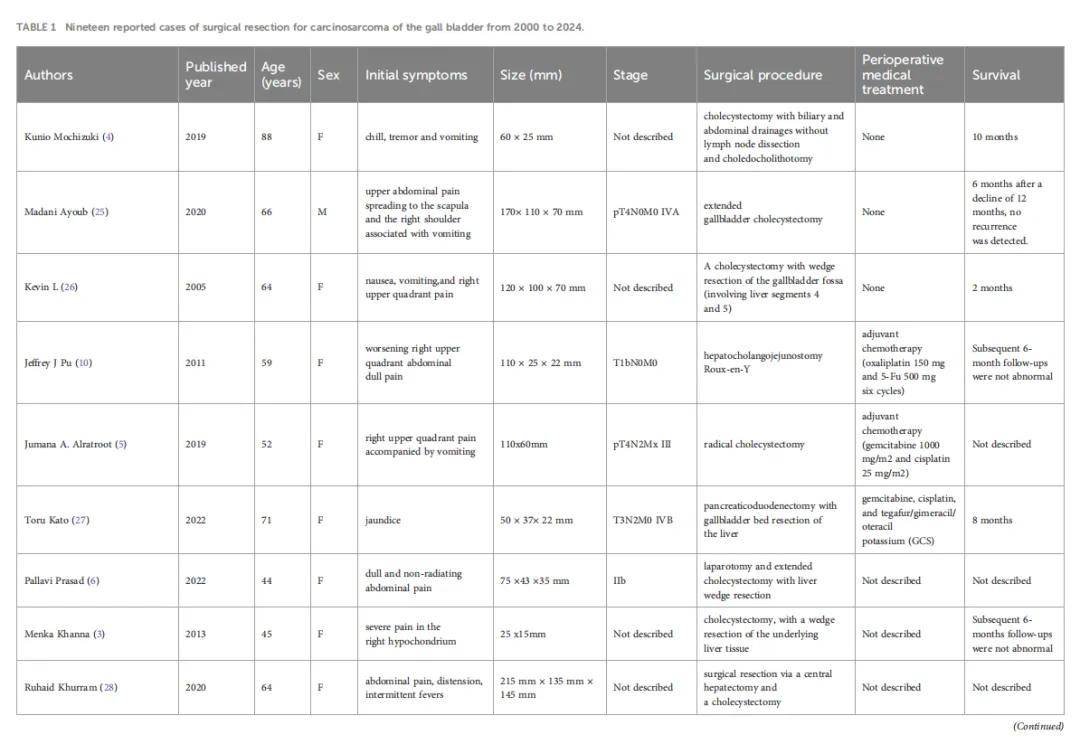
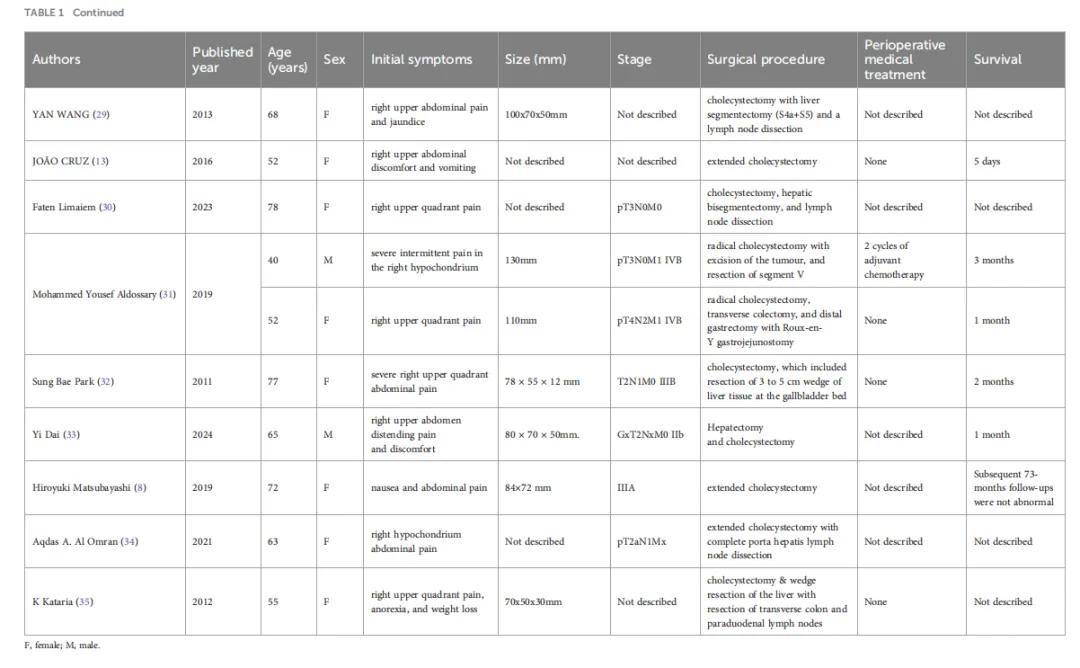
▲表1 2000 年至 2024 年间报告了 19 例胆囊癌肉瘤手术切除病例
为消除或控制潜在微转移灶并延缓患者疾病进展,胆囊癌肉瘤(CSGB)患者通常推荐术后辅助治疗。Chen等人分析了 11 例接受辅助化疗的CSGB患者,其中以吉西他滨或顺铂为基础的化疗方案更为常见。接受化疗的患者中位生存期较未接受辅助化疗者延长 9 个月,提示辅助化疗可能在一定程度上改善患者预后,但该研究的局限性在于样本量小,未能充分阐明化疗获益。安罗替尼等靶向治疗也可用于CSGB患者并显示出良好疗效,可能成为未来潜在治疗手段。此前已有吉西他滨联合奥沙利铂(GEMOX方案)联合抗PD-1治疗CSGB达到完全缓解的病例报道。CSGB放疗病例报道较少,其疗效仍存争议。
KRAS基因属于RAS家族,是癌症中常见的致癌基因之一,具有多种突变位点,最常见的包括G12C、G12D和G12V。本例患者存在相对罕见的KRAS G12V突变,提示为致病性突变,但目前尚无对应药物上市。当前,携带KRAS G12V突变的CSGB患者较为罕见,含KRAS G12V突变的肿瘤患者通常预后较差。胰腺癌组织中KRAS突变与无病生存期及总生存期(OS)较差相关,且KRAS G12V突变(P=0.001)是晚期胰腺癌患者OS的独立不良预后因素;KRAS G12V突变与循环调节性T细胞水平升高相关,二者均与晚期胰腺癌患者预后较差相关。Prajish Iyer等人的研究证据表明,KRAS G12V(而非G13D)突变可能使胆囊癌患者无法响应抗EGFR治疗——KRAS G13D突变对抗EGFR治疗敏感,而G12V突变则表现为耐药。忽视KRAS激活突变可能导致对患者预后的判断不准确。因此,胆囊癌肉瘤患者的基因检测对评估患者预后及耐药性具有重要意义。KRAS G12V突变与胆囊癌肉瘤患者预后的关系仍有待进一步研究。针对KRAS G12C突变的抑制剂研究已取得显著进展,如索托雷塞(Sotorasib)可用于治疗携带KRAS G12C突变的非小细胞肺癌患者。目前KRAS G12V突变尚无对应上市药物,但相关研究正在进行中。例如,Enrica等人针对携带KRAS G12V突变的非小细胞肺癌的研究报道,使用FAK抑制剂VS-6766联合地法替尼(Defactinib,德福替尼)显示协同抗肿瘤活性。此外,KRAS抑制剂RMC-6236对包括KRAS G12V突变在内的多种RAS突变肿瘤(如肺癌、胰腺癌等)同样有效。未来,有望研发更多针对KRAS G12V突变的抑制剂,为携带此类突变的患者(包括CSGB患者)提供新的治疗选择。
回顾本例患者的术后治疗,考虑到患者术后化疗方案选择需兼顾癌与肉瘤成分的平衡,采用了对药物更敏感的紫杉醇及异环磷酰胺进行 6 个周期化疗,患者无病生存期达 16 个月。一项III期随机对照试验将 685 例不可切除或转移性胆道癌(BTC)患者随机分配至抗PD-L1药物度伐利尤单抗联合顺铂+吉西他滨组(最多 8 个周期)或安慰剂联合顺铂+吉西他滨组,结果显示度伐利尤单抗组与安慰剂组患者的中位总生存期(OS)分别为 12.8 个月和 11.5 个月,中位无进展生存期分别为 7.2 个月(95% CI, 6.7-7.4)和 5.7 个月(95% CI, 5.6-6.7),3或4级不良事件发生率分别为 75.7% 和 77.8%。本例患者存在BRCA1突变。晚期BTC中BRCA1/2突变的频率和类型存在差异,部分携带胚系BRCA突变的BTC患者较携带体细胞突变的BTC患者治疗结局更优,且携带BRCA突变的患者更可能从单药或联合免疫治疗中获益。在胰腺导管腺癌中,BRCA1和BRCA2蛋白通过同源重组参与DNA损伤识别与修复,其突变会导致双链DNA断裂无法修复,并增加对铂类等细胞毒性药物的敏感性;使用铂类化疗方案可改善BRCA1/BRCA2突变患者的OS和无病生存期(DFS)。乳腺癌中BRCA1突变患者较BRCA2突变患者从铂类方案中获益更多,提示BRCA1突变患者可能对铂类药物治疗更敏感。参考其他肿瘤相关研究结果并结合患者BRCA1突变情况,患者在疾病复发转移后调整化疗方案为GP方案联合度伐利尤单抗,同时口服对肉瘤有效的安罗替尼。已有报道免疫治疗联合化疗用于胆囊癌肉瘤并取得良好效果。提示应用作用机制不同的药物可能有助于提高疾病联合治疗的疗效,改善机体免疫抑制状态,从而提高总生存率。因患者出现IV度骨髓抑制,化疗方案调整为含奥沙利铂、对患者更敏感的XELOX方案,同期间断口服安罗替尼靶向治疗。治疗期间患者出现发热、黄疸等胆道感染症状,检查提示胆汁淤积,经皮肝穿刺胆道引流术(PTCD)后梗阻症状得到良好缓解,通过积极处理并发症,在很大程度上改善了患者的生存质量及生存期。
本例患者罹患罕见的携带KRAS G12V突变的胆囊癌肉瘤,现有报道提示此类疾病预后极差。然而,通过多学科协作,并基于循证医学原则,根据患者自身状况、肿瘤具体部位、病理类型及侵犯范围合理应用多种治疗手段,该患者的生存质量得到了相对改善,生存期得以延长。然而单病例报告的参考价值存在局限性。研究人员期待未来开展更多关于胆囊癌肉瘤的临床研究,以规范该疾病的诊疗。同时,也期望针对胆囊癌肉瘤患者(包括KRAS G12V突变在内的)基因突变的研究能进一步推进,为这一患者群体提供新的治疗选择。
参考文献:
Liao Y, Lai J, Yang J, Long T, Wu X, Luo D, Tan J, Zhang K, Tang J, Xie L. Long-term survival was achieved through multidisciplinary treatment of a patient with gallbladder carcinosarcoma accompanied by KRAS mutation: a case report and literature review. Front Oncol. 2025 Mar 27;14:1506949. doi: 10.3389/fonc.2024.1506949. PMID: 40231011; PMCID: PMC11995190.





