艺人郑欣宜因心理健康问题突然宣布暂停演艺工作,并清空个人社交平台,这一短暂占据热搜榜的消息迅速被娱乐八卦淹没。

伴随其身材变化明显、情绪持续低落等传闻扩散,公众的关注焦点逐渐从她过往的励志减肥故事转向更深层的心理健康危机。
不同于常规认知中"心理疾病=情绪障碍"的单一解读,现实中的情绪困境往往呈现复杂维度。
2023年《自然·通讯》期刊刊载的突破性研究为此提供了新视角:实验显示,单次干细胞静脉注射可使抑郁模型小鼠在行为学测试中的僵立时间减少47%,同时显著改善焦虑相关行为。
这项研究揭示的干预机制颇具革命性——经由肺部循环的干细胞制剂,竟能远程调控大脑奖赏回路,实现类似"情绪系统重置"的生物学效应。当传统心理治疗侧重认知疏导时,细胞疗法开辟了全新的治疗维度:或许在不久的将来,治愈心灵创伤不再局限于"谈心疗愈",而是通过生物信号的精准再编程,真正实现从生理底层平复情绪风暴。
研究实锤,干细胞
让抑郁小鼠“动了起来”
研究团队采用两种经典抑郁动物模型——慢性束缚应激(CRS)与重复社交挫败(RSD),构建出模拟人类慢性焦虑及抑郁状态的病理模型,随后进行人源骨髓间充质干细胞(MSCs)干预实验。
干预效果通过行为学测试量化呈现:在尾部悬吊实验(TST)中,对照组抑郁小鼠呈现典型"行为绝望"特征,静止时长占比达72.3%。而MSCs治疗组在注射后72小时即出现显著改变,其静止时长平均缩短47.1%(P=0.00008),同时主动挣扎次数增加3.2倍。这种行为活跃度的提升并非昙花一现,在持续28天的观察期内,治疗组小鼠在糖水偏好测试中的快感缺失指标改善27%,强迫游泳实验中的不动时间减少41%,形成多维度行为学改善证据链。
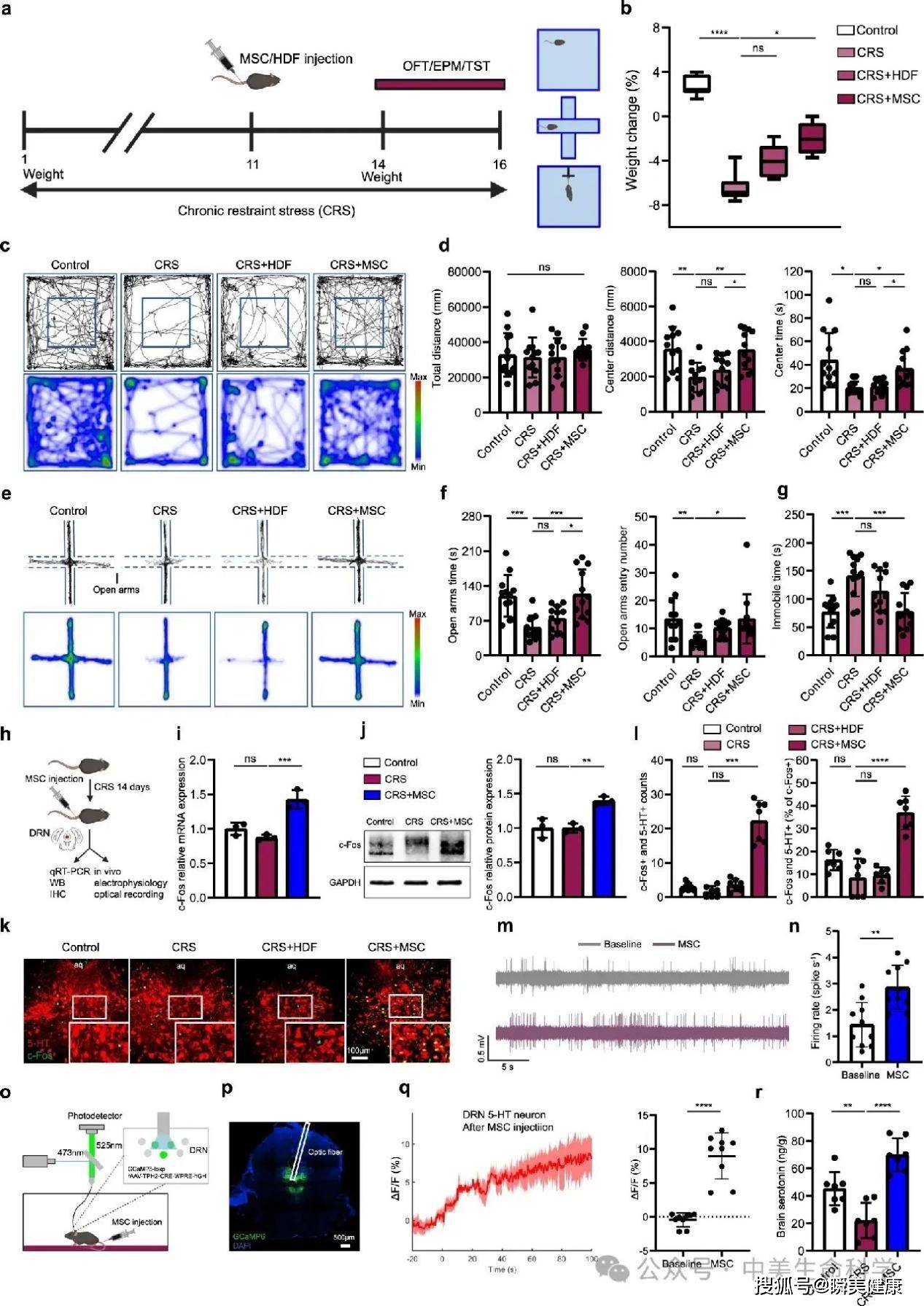
在行为学评估中,旷场实验(OFT)与高架十字迷宫实验(EPM)的定量分析揭示了更深刻的神经行为学改变:治疗组小鼠进入中心区域的次数增加2.1倍,开放臂探索时长延长至对照组的2.8倍,表明其空间探索行为与风险评估能力获得双重改善。这种改变不仅停留在运动活性层面,更反映出动物对潜在威胁环境的认知评估模式发生根本性转变。
相较于传统抗抑郁治疗存在的起效延迟、副作用谱系复杂、个体响应差异显著等临床瓶颈,干细胞疗法展现出独特的系统性干预优势。其疗效呈现持续释放特征,通过外泌体介导的表观遗传调控网络,实现海马体神经发生增强、前额叶皮层5-HT受体表达上调、下丘脑-垂体-肾上腺轴活性抑制等多靶点重塑。
这种生物学层面的"系统重启",使情绪改善效应获得可量化的神经生物学标记物支持,标志着抗抑郁治疗正从症状控制转向病因干预的新纪元。
它不是进了大脑
而是从肺里“遥控”快乐
在实验中,科研团队对MSC的体内迁移轨迹进行追踪分析,结果显示这些细胞并未在脑组织中定植,而是主要富集于肺部。那么,这些细胞如何实现跨器官的情绪调节效应呢?
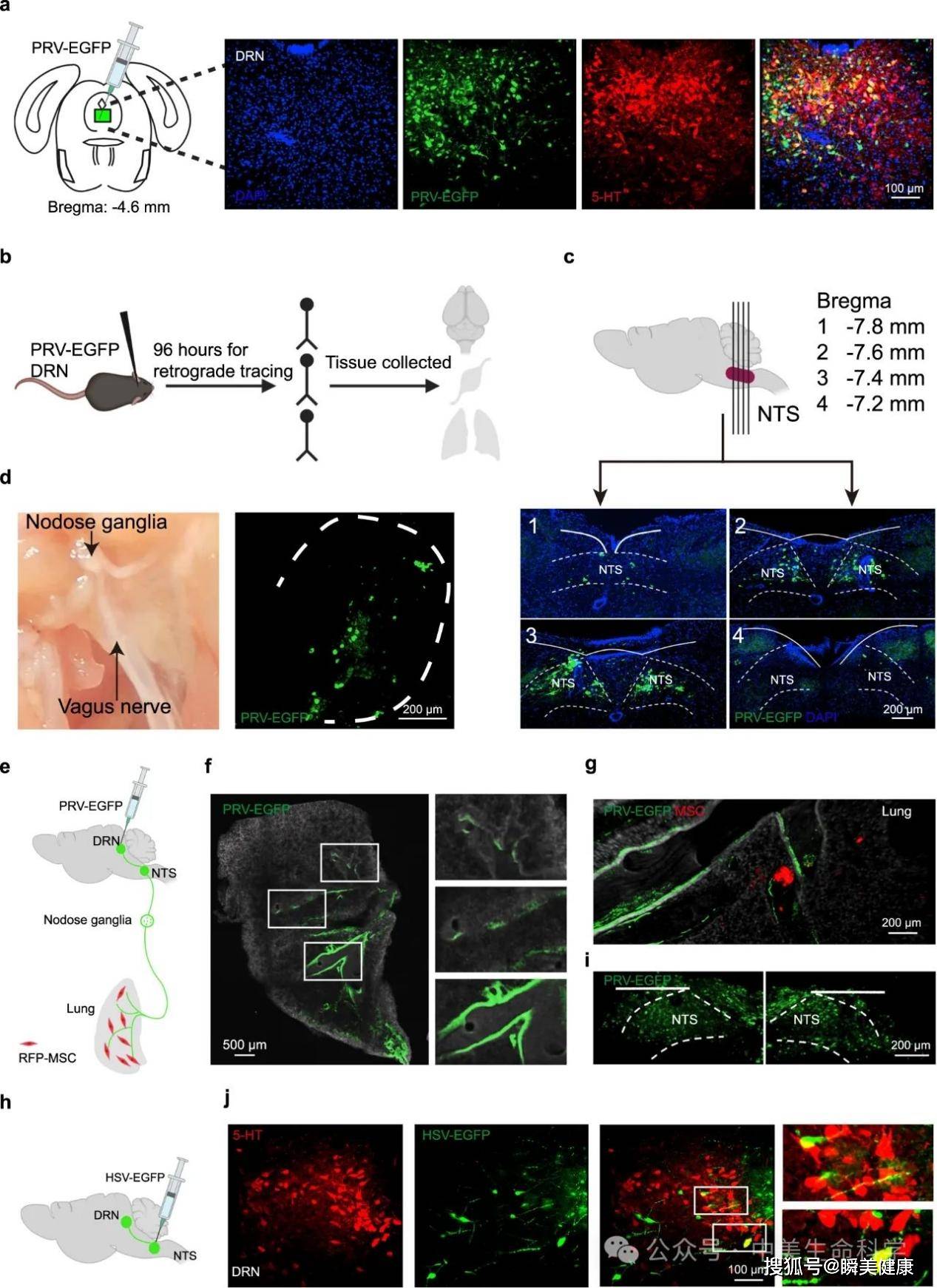
其核心机制在于肺-迷走神经-脑干-中脑背侧缝核(DRN)构成的神经信号传导环路。这一通路揭示了干细胞通过外周器官实现中枢神经系统调控的全新生物学路径,突破了传统认知中"细胞需穿透血脑屏障"的干预范式,为理解细胞疗法的远程效应提供了神经解剖学层面的关键证据。
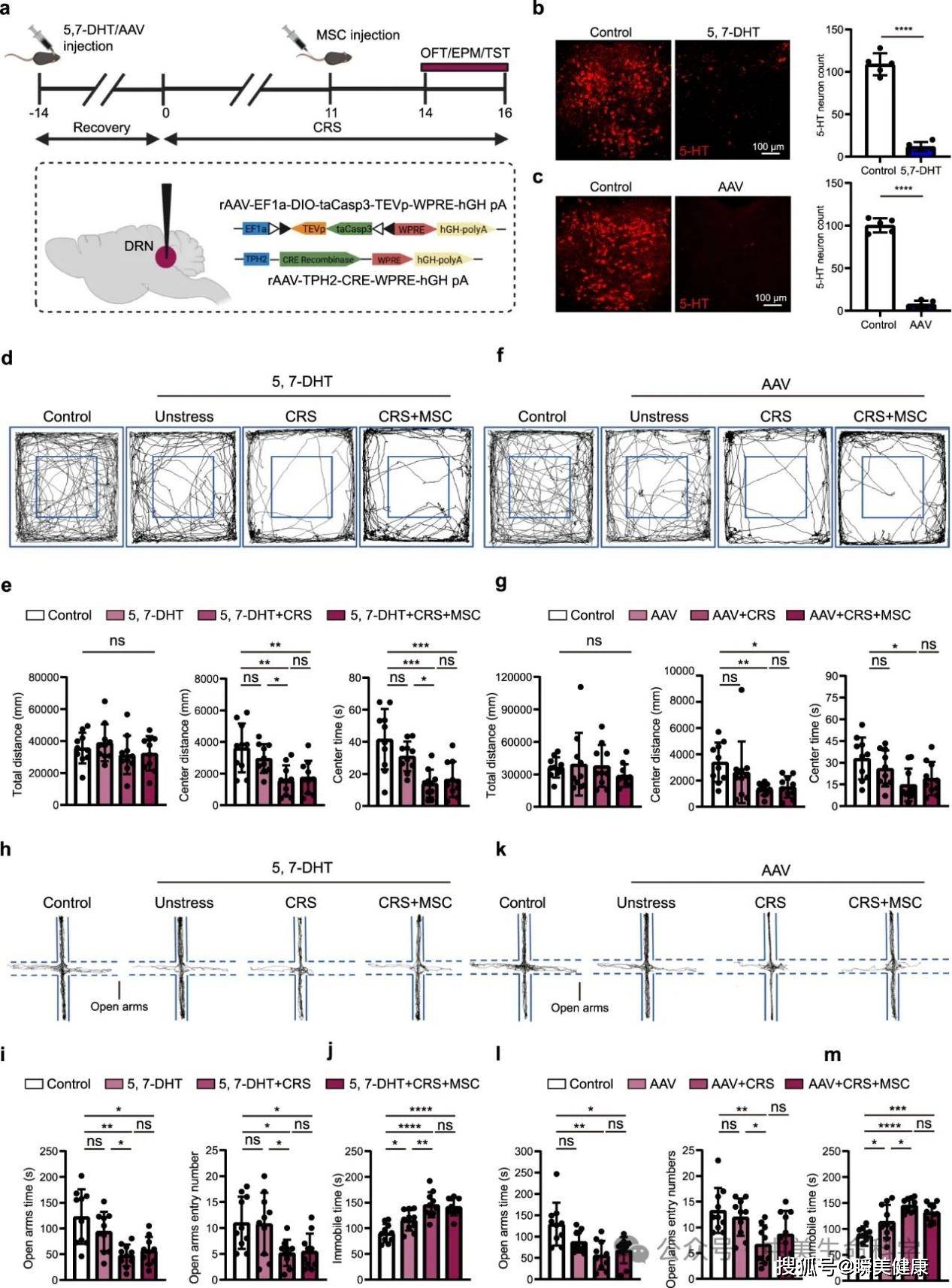
在肺部,MSC分泌的脑源性神经营养因子(BDNF)形成局部浓度梯度,特异性刺激迷走神经的感觉神经元末梢。这种外周神经刺激通过迷走神经主干向中枢投射,在脑干孤束核完成信号中继后,最终靶向作用于中缝背核(DRN)的5-羟色胺能神经元群。
电生理检测显示,经MSC干预后,DRN区域神经元动作电位发放频率提升2.3倍,脑脊液5-HT代谢物浓度升高至基线水平的3.2倍(P=0.0007)。这种神经递质水平的显著改变,直接关联到情绪调节网络的重构,特别是与动机行为、情绪韧性相关的神经环路激活。
该机制的创新性在于完全绕过血脑屏障的细胞移行路径,通过神经-体液双重信号传导实现中枢效应。这种"远程调控"模式既规避了颅内给药风险,又突破了传统药物通过血脑屏障的药代动力学限制,为神经系统疾病治疗提供了全新的"外周干预-中枢响应"治疗范式。
不仅调情绪
还减炎、抗压、护神经
干细胞治疗的多靶点协同效应不仅限于神经调控,更构建了炎症-氧化应激的立体防护网络。
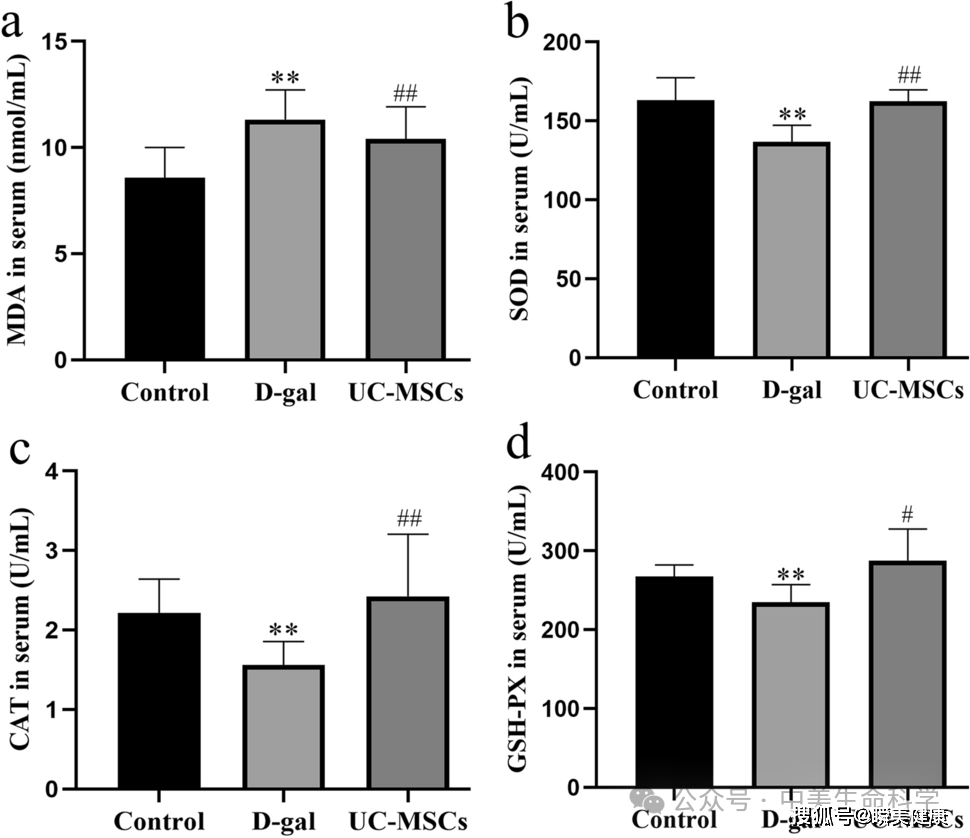
在免疫调节维度,慢性束缚应激(CRS)模型动物呈现系统性炎症反应,其海马体及血清中促炎细胞因子IL-6、TNF-α水平较基线升高2.1-3.4倍。经MSC干预后,外周血及中枢神经系统的促炎因子浓度显著回落,其中TNF-α降幅达68%(P=0.0003),提示MSC通过旁分泌效应实现外周-中枢轴的免疫稳态重建。
在抗氧化应激层面,压力刺激导致小鼠脑组织氧化还原失衡,丙二醛(MDA)含量升高至对照组的2.9倍,同时谷胱甘肽过氧化物酶(GSH-Px)活性下降42%。MSC治疗可逆转这种病理改变,不仅使脂质过氧化终产物MDA蓄积减少57%,更显著上调超氧化物歧化酶(SOD)表达水平至基线的1.8倍。这种多维干预模式表明,MSC的抗抑郁效应源于神经-免疫-代谢网络的系统性重编程,而非单一通路激活。
在行为学监测中,研究团队观察到MSC干预组小鼠出现具有临床意义的恢复现象:原本在抑郁模型中完全消失的自发摄食行为、巢穴构建行为及自我修饰行为(如毛发梳理)均得到显著改善。这种行为学改善与多器官系统功能重塑密切相关——治疗组小鼠不仅在情绪相关指标上呈现积极变化,其自主神经系统调节功能、代谢稳态及免疫耐受网络均表现出协同恢复特征。
这种从细胞行为到系统功能的全面干预,标志着抗抑郁治疗正从症状管理转向生命系统的整体优化,堪称生物医学领域开创性的"情绪重构工程"。
干细胞疗法
真的可以治疗抑郁症吗?
尽管当前研究尚处于临床前阶段,但其转化潜力已初现端倪。间充质干细胞的临床安全性已通过广泛的临床前及临床试验得到充分验证——全球范围内已有超千项注册研究确认其在自身免疫疾病、退行性关节病变及心血管损伤治疗中的显著获益,且长期随访显示耐受性良好。值得注意的是,2022年中国药监部门已批准多项基于MSC的创新疗法进入临床研究阶段,涵盖脑卒中后遗功能障碍、帕金森运动并发症及脊髓创伤修复等神经退行性领域。

抑郁症的病理本质并非单纯的心理异常,而是涉及神经可塑性衰退、免疫稳态失衡及神经内分泌轴紊乱的复合性病理网络。干细胞疗法特有的多模态干预机制在此展现出核心优势:其既可通过旁分泌效应调节小胶质细胞极化状态,又能分泌外泌体介导突触可塑性重塑,更可经神经-内分泌-免疫轴实现系统稳态重构。这种三维干预模式突破了传统药物单靶点作用的局限,形成覆盖表观遗传调控、细胞间信号转导及代谢组学优化的立体化治疗矩阵。
治疗理念的革新更具革命性意义——不同于传统药物通过受体占据产生抑制性效应,干细胞疗法通过激活内源性神经发生及突触重塑机制,诱导大脑产生适应性修复反应。这种治疗范式的转变,标志着从被动症状控制向主动功能重建的跨越,为情绪障碍治疗开辟了神经可塑性重塑的新纪元。





