背景介绍

慢性肾病(CKD)正日益被视为一种全球性的健康负担。CKD与动脉粥样硬化的进展直接相关,并且慢性肾病的发展会使发生心血管事件的风险增加。高密度脂蛋白(HDL)的反向胆固醇运输能力使其发挥出保护动脉粥样硬化的作用。另外,HDL具有抗炎和抗氧化特性。但是,CKD患者的HDL促进疗法未能实现心血管结局的明显增强,表明HDL的功能似乎比HDL的数量更重要。作为HDL中主要的蛋白,甲基化的载脂蛋白A-I(ApoA-I)能够抑制巨噬细胞的胆固醇外排,发挥保护作用。先前的研究表明,在慢性肾病 5 期患者体内,白蛋白会发生胍基化现象,妨碍疏水性物质与白蛋白的结合。但目前尚未有关于人类体内 ApoA-I 胍基化的研究报道。研究HDL的质量而非数量,并探索恢复 HDL 功能的潜在干预措施,对于改善慢性肾病患者的心血管风险具有重要意义。
文章内容

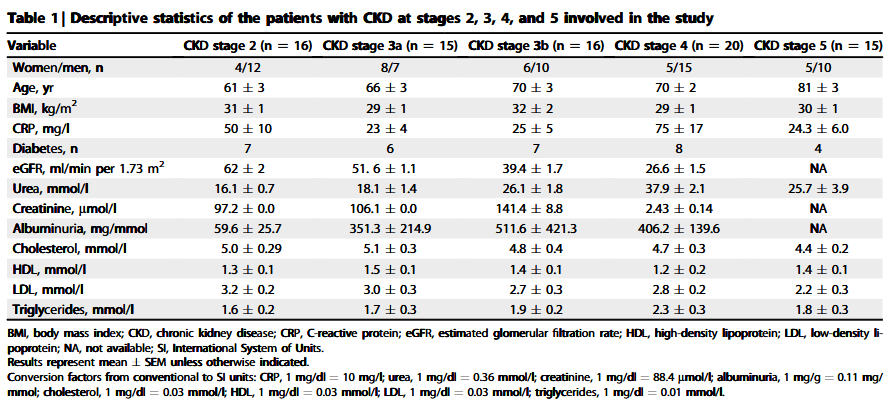
表格 1 纳入CKD患者的基线数据表
研究者从亚法大学医院招募了82名CKD 2期-5期的患者(表格1),并对其血浆蛋白进行了蛋白质质谱分析。他们发现,CKD患者中ApoA -I的胍基化与疾病呈现阶段依赖性增加趋势(图1),并且ApoA -I胍基化修饰的量不仅与肾小球过滤率相关,而且与尿素和血肌酐水平正相关(表格2)。
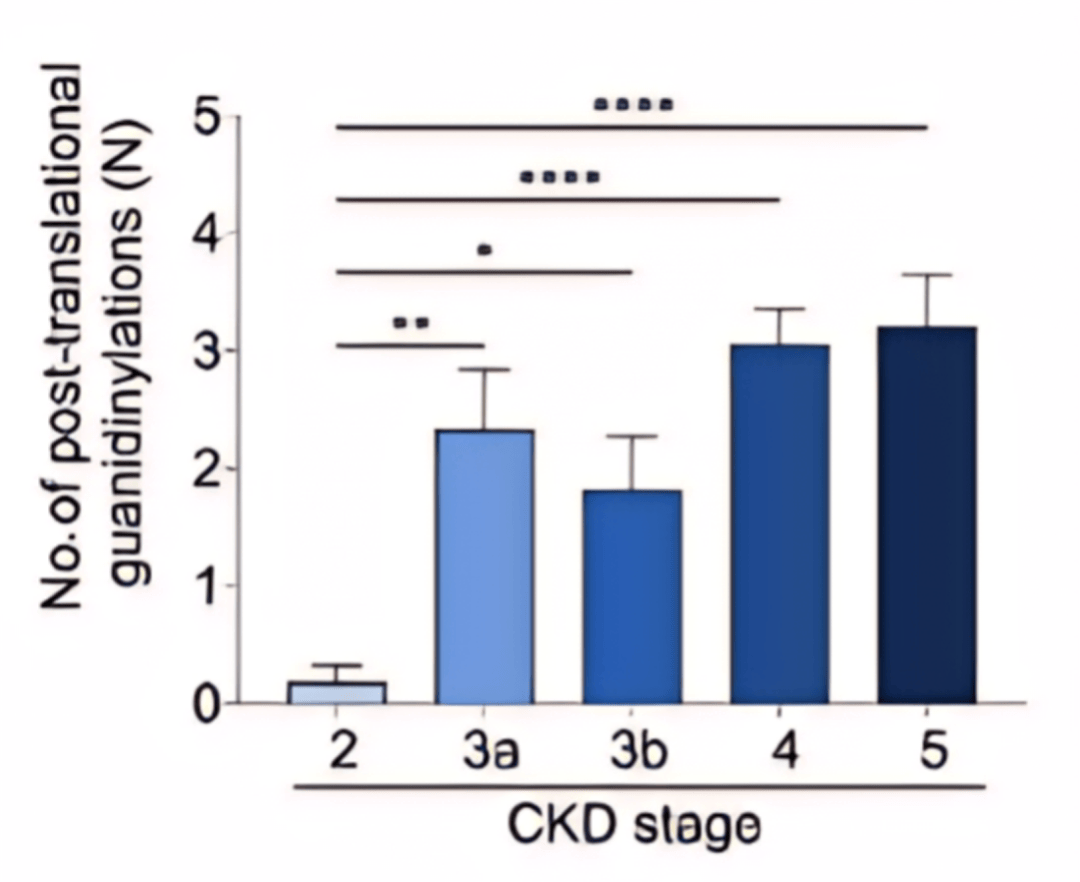
图 1 CKD不同分期患者中的ApoA -I的胍基化修饰水平
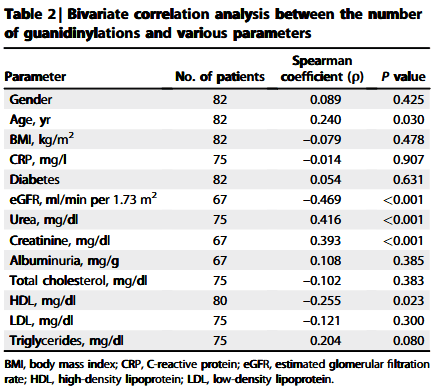
表格 2 ApoA -I的胍基化和临床指标的相关性
研究者们在ApoA -I的氨基酸序列中的不同位置观察到了胍基化修饰的位点(图2)。
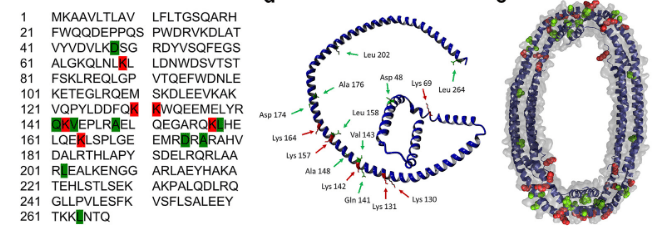
图 2 ApoA -I的氨基酸序列中的胍基化修饰的位点及晶体结构(带有胍基的氨基酸用绿色标出,带有胍基的赖氨酸则用红色标出)。
动物层面,与健康或野生型小鼠相比,在导致慢性肾脏功能不全的三种不同动物模型(2,8-DHA肾病,5/6-肾切除及Cola4a3敲除)的血浆中,他们均观察到ApoA -I胍基化的增多。此外,在小鼠的肾脏及主动脉中也观察到了ApoA -I胍基化的累积(图3)。
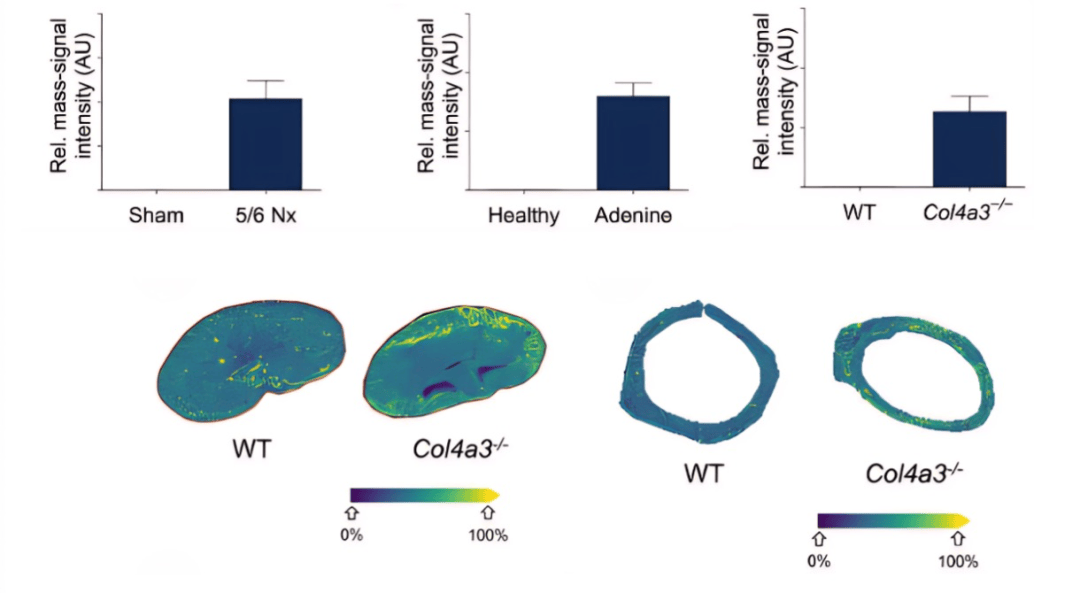
图 3 慢性肾脏病小鼠模型血浆和肾脏中的胍基化ApoA-I的水平
在骨髓来源的巨噬细胞(BMDM)中,胍基化的ApoA-I失去了原有的降低炎性因子(IL-6,TNF,CCL2)的功能。此外,未修饰的ApoA-I能够减少了细胞中的氧化应激,但胍基化的出现则废除了ApoA-I的这种能力(图4)。
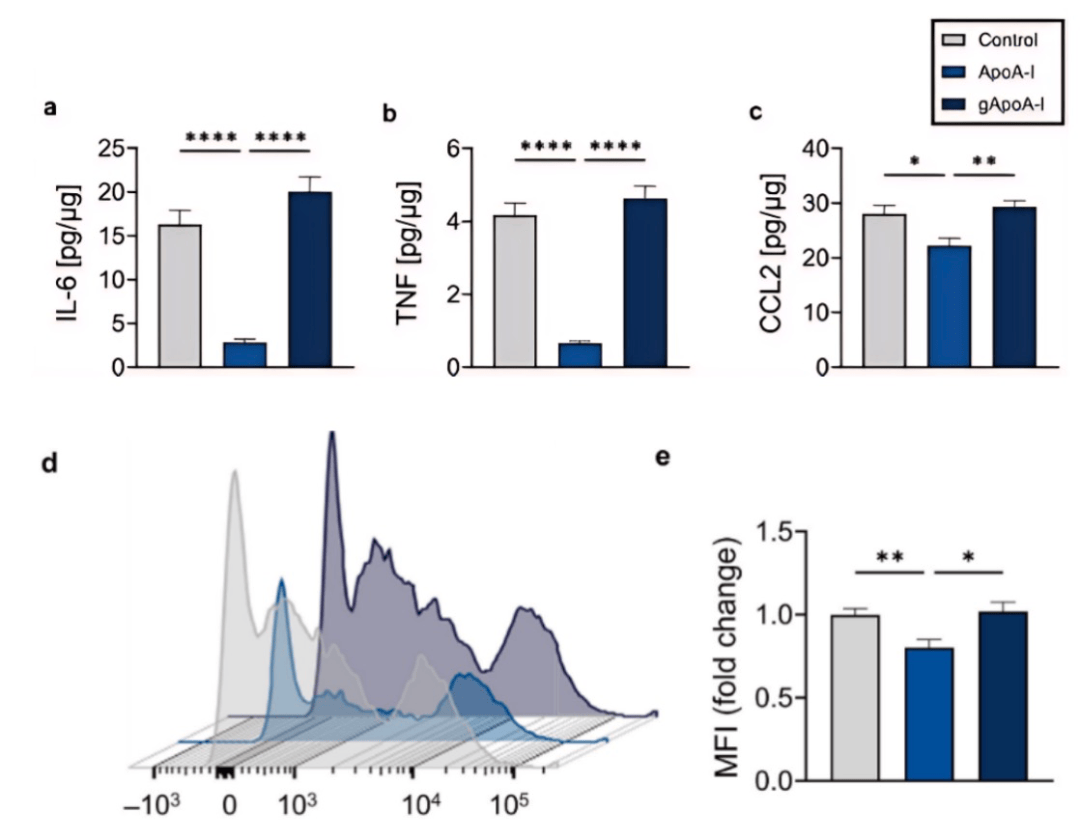
图 4 BMDM中胍基化的ApoA-I抗炎抗氧化功能的消失
与未经修饰的ApoA-I处理的细胞相比,在用胍基化的ApoA-I处理的BMDM中,43个激酶的激酶活性显着上调(图6E)。与炎症相关的途径再次具有很强的富集。这也与功能观察结果一致,即胍基化ApoA-I导致ApoA-I·的抗炎特性丧失。总之,未修饰的ApoA-I表现出能够抑制炎症激酶活性的能力,而ApoA-I的翻译后胍基化则引发了炎症信号级联反应的强烈诱导(图5)。
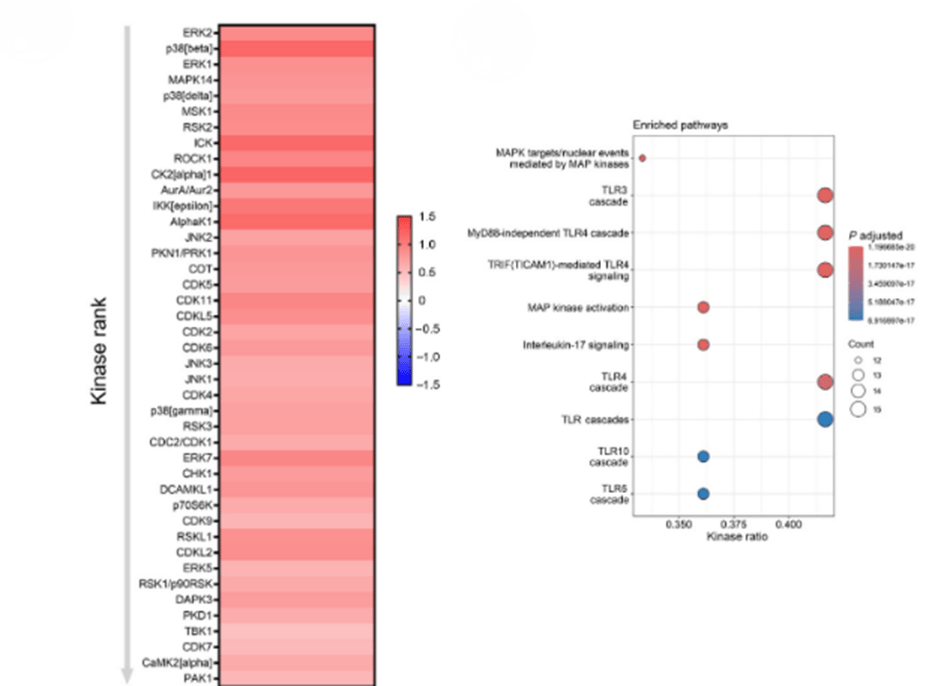
图5
这些发现支持了慢性肾脏病患者中ApoA-I 功能特性因胍基化而发生改变的观点。血浆中高浓度的胍基化ApoA-I 水平凸显了慢性肾脏病病理生理过程中蛋白质修饰的一个新方面。其研究结果可能有助于更好地理解慢性肾脏病相关心血管并发症的分子机制,并强调了在慢性肾脏病患者中减少翻译后修饰的重要性与必要性。


供稿丨陆放 邢昌赢



