【导读】KRAS 突变在超过 90%的胰腺导管腺癌(PDAC)病例中被发现,这使得 PDAC 对化疗具有内在耐药性,并重塑了免疫抑制性肿瘤微环境(TME),令临床上首选的化疗 - 免疫治疗组合令人失望。
7月8日,复旦大学研究团队在期刊《Advanced Science》上发表了研究论文,题为“Cascade-Targeted Nanoparticles for Enhanced Gemcitabine Delivery and Adenosine Metabolism Modulation to Overcome Treatment Resistance in Pancreatic Cancer”,本研究中,研究人员制备了对活性氧(ROS)响应的带正电聚合物 B-PDEA,并将其组装成聚复合物以负载下调 CD39 的小干扰 RNA。通过酶可裂解肽将负载吉西他滨的白蛋白与聚复合物偶联,形成完整的纳米颗粒,用于一线化疗药物和 CD39 调节核酸的共递送,显示出增强的吉西他滨细胞内递送能力和腺苷代谢调节能力。这种方法通过改变肿瘤微环境中的代谢免疫交互作用,激活了抗肿瘤免疫反应,同时实现了化疗增敏,展现出治疗胰腺导管腺癌的巨大潜力。

背景知识
01
临床上,超过 90% 的胰腺导管腺癌(PDAC)病例携带 KRAS 基因突变,具有高度侵袭性和恶性增殖的特点。KRAS 突变改变了 PDAC 的物质运输和代谢模式,导致其对化疗和免疫治疗产生内在耐药性。尽管一线临床治疗方案是化疗(吉西他滨 + 白蛋白结合型紫杉醇)+ 免疫治疗(抗 PD-1 治疗,如帕博利珠单抗),但上述联合方案的疗效仍难以令人满意。
在原位胰腺导管腺癌模型中增强的抗肿瘤功效
02
受纳米颗粒在体外显著的腺苷代谢调节抗肿瘤及免疫激活能力的鼓舞,研究人员采用携带原位胰腺导管腺癌肿瘤的雄性 C57BL/6 小鼠评估了其体内抗肿瘤及微环境调节效果。在肿瘤植入 10 天后,每隔 3 天静脉注射不同药物或纳米颗粒,共注射 4 次。每隔一天测量并记录小鼠体重变化。从肿瘤植入第 8 天起,每 5 天用 IVIS 监测一次每只小鼠的肿瘤体积,共监测 4 次。结果表明,在所有治疗组中,siCD39@BPDEA-pep-Alb 治疗组(G6)肿瘤生长最慢,生存时间最长,表明完整纳米颗粒具有良好的应用前景。在治疗过程中,各组小鼠平均体重保持稳定,表明其具有良好的系统安全性。为检查治疗是否造成任何异常,研究人员进行了苏木精 - 伊红(H&E)染色。收集每组的血浆,以检测肝酶水平以及肾功能指标。组织学结构和生化参数得以维持,表明完整纳米颗粒具有良好的生物相容性。
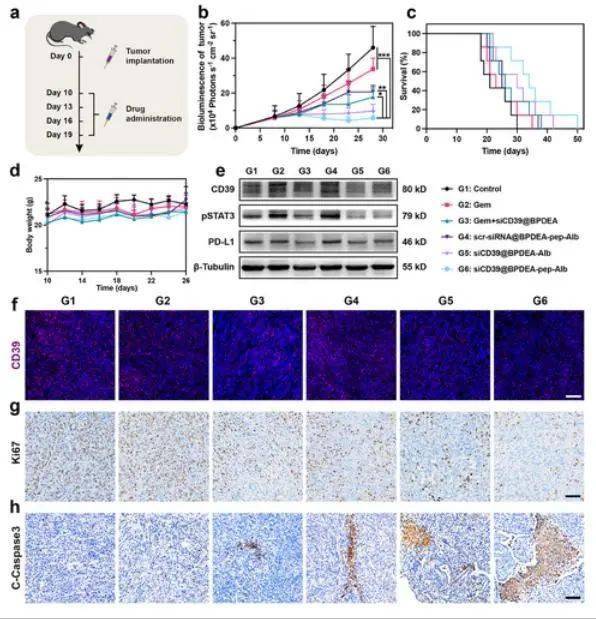
原位胰腺导管腺癌模型中的抗肿瘤疗效
研究人员进一步研究了不同治疗方法的抗肿瘤效果及机制。在吉西他滨(G2)和 scr-siRNA@BPDEA-pep-Alb(G4)治疗组中,CD39 表达显著上调,这表明化疗加剧了异常的腺苷代谢,而这一现象在其他治疗组(G3、G5 和 G6)中可通过 siCD39 得以逆转。通过免疫荧光染色也观察到了类似的结果,证实了含 siCD39 纳米颗粒的 CD39 抑制能力。研究表明,治疗后还发现 STAT3 激活和 PD-L1 表达受到抑制,表明纳米颗粒具有重塑免疫微环境和阻断潜在免疫逃逸途径的能力。与体积增长和生存时间延长的趋势一致,siCD39@BPDEA-pep-Alb 治疗组(G6)的肿瘤样本显示出最低的增殖标志物 Ki67 和最强的凋亡标志物C-Caspase3信号强度,表明其具有最佳的抗肿瘤能力。此外,研究进一步证实了代谢微环境调节对基质的调节作用。
参考资料:
【关于投稿】