近年来,癌症免疫疗法取得成功,新抗原癌症疫苗被视为对抗肿瘤的有力工具。尽管已有超百项相关临床试验,但多数未证实其明确疗效。 本文聚焦疫苗设计和肿瘤环境相关的关键障碍,探讨如何释放新抗原疫苗在癌症治疗中的潜力,同时提出临床试验报告建议,以推动其临床应用。
一、引言:新抗原癌症疫苗的机遇与挑战
二、设计有效的新抗原疫苗
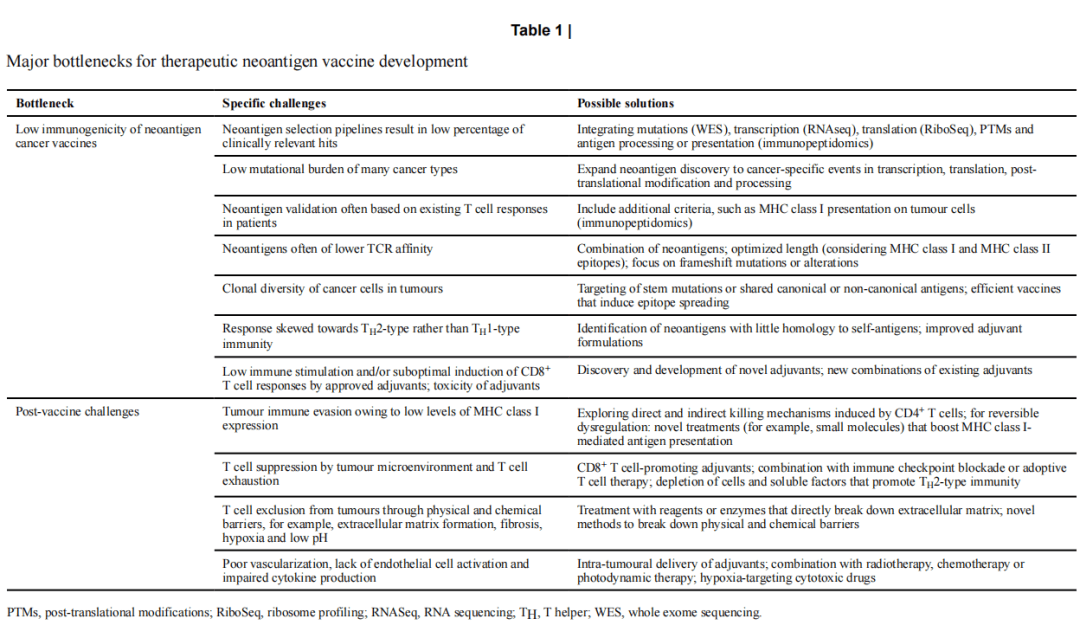
1.疫苗平台的免疫原性现状:当前,基于肽、DNA、RNA、腺病毒和树突状细胞等多种新抗原靶向疫苗平台已进入临床试验,其中超 50% 的试验使用合成长肽(SLPs)加佐剂组合。然而,这些平台存在整体免疫原性低的问题,试验中诱导的新抗原特异性 T 细胞反应,尤其是细胞毒性 CD8+ T 细胞反应,在患者外周血中常无法检测到或非常微弱。与成功的病原体特异性 T 细胞疫苗相比,新抗原疫苗诱导的 T 细胞反应水平极低。此外,新抗原疫苗临床研究常忽视辅助性 T 细胞 2(TH2)细胞免疫的诱导,而大多数获批佐剂为诱导体液免疫优化,倾向于诱导 TH2 细胞反应,不利于抗肿瘤免疫,因此需优化疫苗平台并重视相关免疫反应的评估(见图 1)。
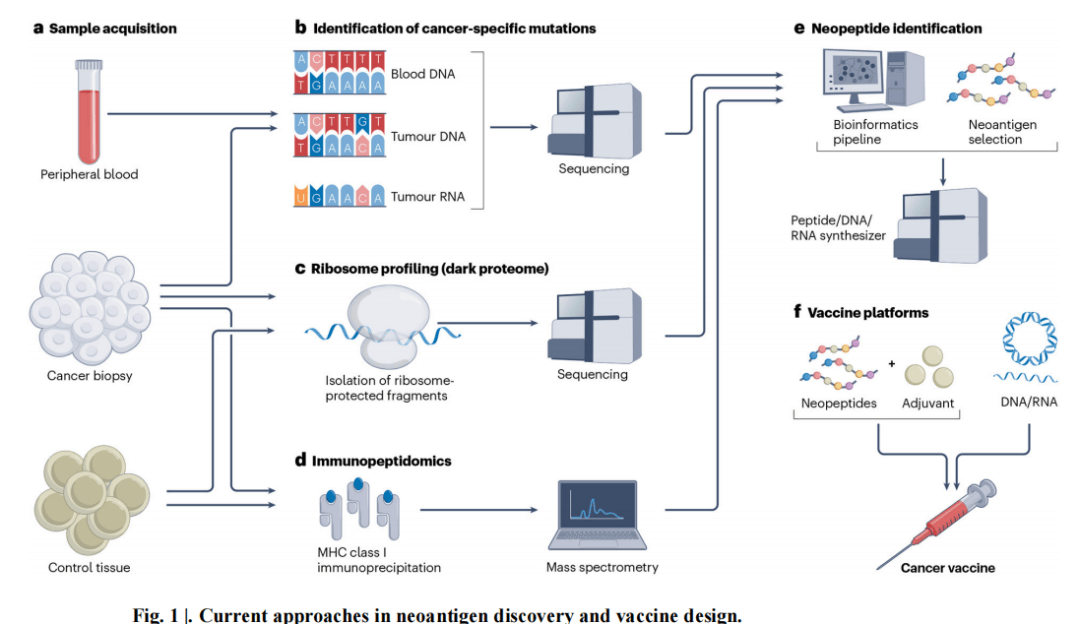
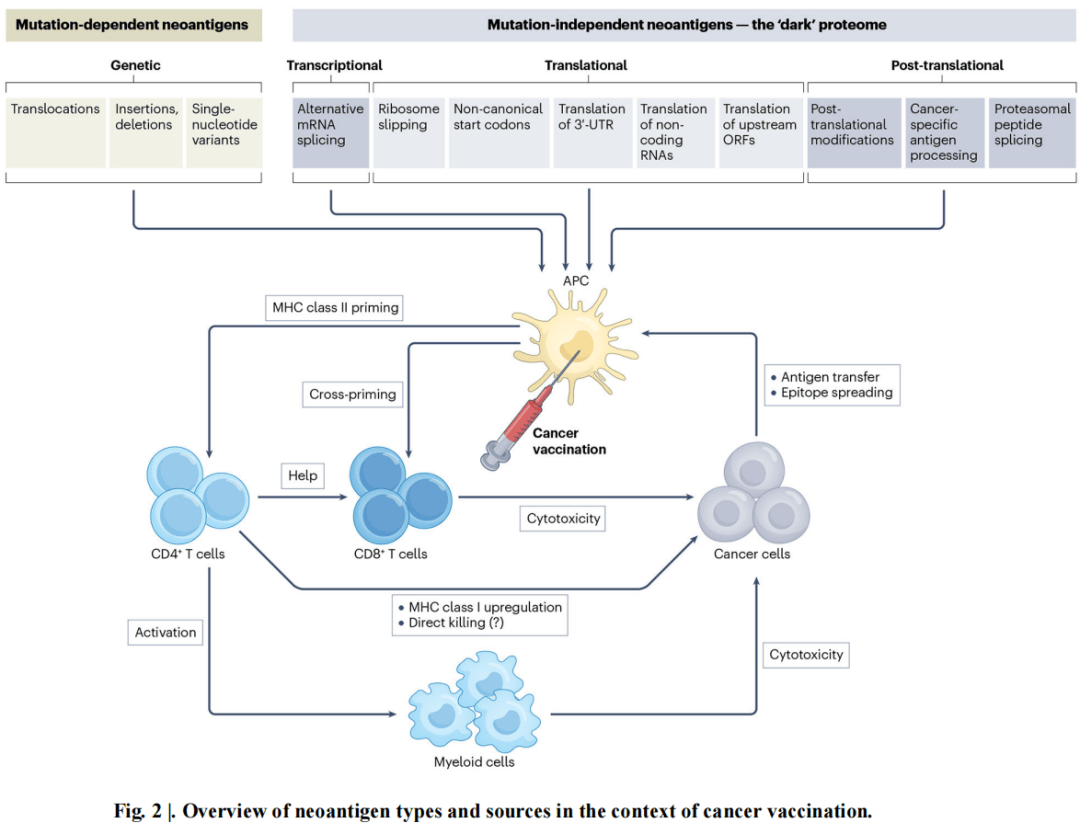
3.利用与突变无关的新抗原:许多癌症突变负荷低,使得基于突变的新抗原策略面临困难,因此需探索与突变无关的新抗原。非规范或 “隐秘” 的转录和翻译改变可产生新抗原,如选择性剪接、使用非 AUG 起始密码子、核糖体移码错误等。这些 “暗蛋白组” 来源的新抗原可能具有肿瘤特异性,但其整体效用仍需进一步研究。
4.疫苗所需新抗原肽的数量和长度:确定疫苗中最佳的新抗原肽表位及数量是重要问题。高 TCR 亲和力的单个新抗原肽可引发肿瘤损伤和免疫反应,但多数新抗原肽 TCR 亲和力低,可能需要多个肽协同作用。新抗原肽的长度也会影响疫苗效果,短肽可能导致免疫耐受,长肽依赖交叉呈递,可能具有免疫优势。
5.促进 T 细胞反应的佐剂:佐剂对新抗原肽疫苗至关重要,现有获批佐剂主要用于诱导抗体介导的保护,诱导 CD8+ T 细胞反应的能力较弱。目前,人们致力于开发增强 T 细胞反应的佐剂,如 PRR 激动剂,一些佐剂组合已显示出协同诱导 TH1 型免疫反应的潜力,但寻找既能增强疫苗免疫刺激能力、促进 TH1 细胞和 CTL 免疫,又能避免过度毒性的佐剂仍是挑战。
三、疫苗接种后的障碍
2.肿瘤微环境对 T 细胞的抑制:肿瘤微环境(TME)中的多种细胞和可溶性因子可抑制疫苗诱导的 T 细胞功能,如调节性 T 细胞、髓源性抑制细胞、肿瘤相关巨噬细胞等,同时 TME 中的树突状细胞可能无法充分激活和成熟,影响 T 细胞的启动和扩增。此外,肿瘤的物理环境,如缺氧、低 pH 值、高间质液压力等,也会损害 T 细胞活性。
3.肿瘤的可及性:诱导强大的新抗原特异性 T 细胞反应后,肿瘤的可及性是关键。“冷” 实体瘤存在物理屏障、血管化不良、缺乏 T 细胞趋化吸引等问题,阻碍 T 细胞进入肿瘤。可通过放疗、化疗、溶瘤病毒等方法破坏肿瘤、诱导炎症,或使用酶类分解细胞外基质来改善 T 细胞的肿瘤浸润(见图 3)。
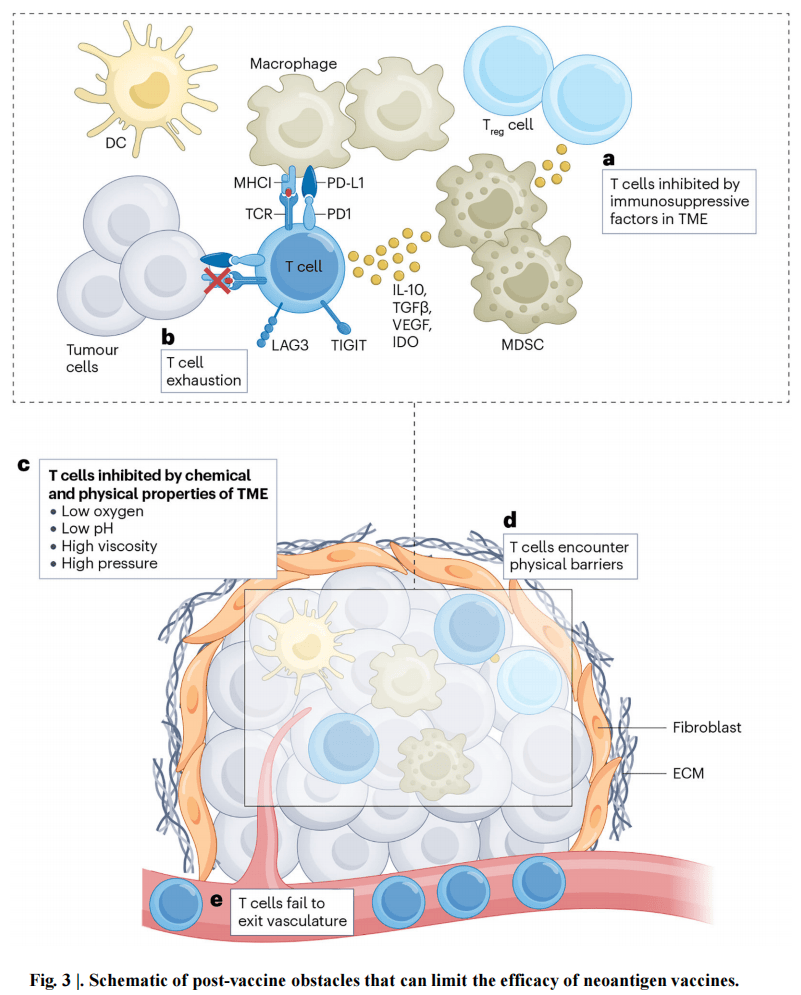
4.T 细胞耗竭和功能障碍:治疗性新抗原疫苗引发的抗肿瘤 T 细胞在高肿瘤负荷下可能会出现功能障碍和耗竭,表现为效应功能丧失、增殖能力下降、抑制性受体表达增加等。联合免疫检查点阻断疗法、靶向代谢或抑制过度的 TCR 信号等方法可能有助于改善 T 细胞耗竭问题。
5.大肿瘤和转移性癌症:新抗原疫苗对大肿瘤或转移性癌症的疗效尚不确定,此类情况下肿瘤负荷高、存在免疫编辑和克隆选择,不同器官的微环境也会影响疫苗效果。联合手术切除、放疗、化疗、免疫检查点阻断疗法或过继性 T 细胞疗法等可能是治疗晚期疾病的必要手段。
四、结论





